
| A、氯化氢 | B、硫酸铜 |
| C、氯化镁 | D、碳酸氢钙 |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、电路中共转移0.9mol电子 |
| B、阳极得到的气体中有O2且其物质的量为0.35mol |
| C、阴极质量增加3.2g |
| D、若改用铜棒做电极电解该溶液,电极反应不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、②③⑥ |
| C、②⑤⑥ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径大小关系是Xn-<Yn+ |
| B、Z一定是稀有气体元素的原子 |
| C、原子序数关系是Z>Y>X |
| D、原子半径关系是Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶质的质量分数为ω=
| ||
| B、用水稀释该溶液,OH- 的物质的量增加 | ||
| C、该溶液中共有6种微粒 | ||
| D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:
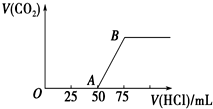 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| O | 2- 4 |
| O | 2- 4 |
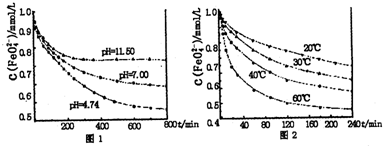
| O | 2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com