
| A. | 氯化氢与氢氧化钠反应的中和热△H=-57.3kJ/mol,则硫酸和氢氧化钡反应的△H=-2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0KJ/mol,则表示一氧化碳的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl(g)△H=-a kJ/mol Ⅱ:  且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol 且a、b、c均大于零,则断开1摩尔H-Cl键所需的能量为(-a-b-c) kJ/mol |
分析 A.硫酸和氢氧化钡反应生成硫酸钡沉淀的过程放热;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C.有些放热反应也需要引发条件才能进行,吸热反应常温下也可以反应;
D.反应焓变=反应物键能总和-生成物键能总和计算.
解答 解:A.氯化氢与氢氧化钠反应的中和热△H=-57.3kJ/mol,硫酸和氢氧化钡反应生成硫酸钡沉淀,沉淀过程为放热过程,焓变为负值,所以反应的△H<-2×(-57.3)kJ/mol,故A错误;
B.CO(g)的燃烧热是283.0KJ/mol,则表示一氧化碳的燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol,故B正确;
C.有些放热反应也需要引发条件才能进行,如氧气和氢气点燃才发生反应,吸热反应常温下也可以反应,如氯化铵和氢氧化钡晶体混合常温下反应,故C错误;
D.对于反应:H2(g)+Cl2(g)=2HCl(g)△H=-a kJ/mol,△H=-a kJ/mol=bKJ/mol+cKJ/mol-2H-Cl,得到断开1摩尔H-Cl键所需的能量=$\frac{1}{2}$(a+b+c)KJ,故D错误;
故选B.
点评 本题从中和热、燃烧热和反应热数值的计算角度对化学反应与能量进行了考查,主要是键能计算焓变的方法,注意把握中和热和燃烧热的定义要点,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 除去氯化钠溶液中的泥沙--蒸发结晶 | |
| B. | 分离水和乙醇--蒸馏 | |
| C. | 用四氯化碳提取溴水中的溴单质--萃取 | |
| D. | 分离汽油和水--分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蓝色石蕊试纸检验溶液的酸性 | |
| B. | 量筒可用于配制溶液,但不能作为反应容器使用 | |
| C. | 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释 | |
| D. | 向燃着的酒精灯中加酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅能与水反应 | |
| B. | 用二氧化硅制取单质硅,当生成2.24 L(标准状况下)气体时,得到2.8g硅 | |
| C. | 二氧化硅属于传统的无机非金属材料 | |
| D. | 二氧化硅不能与碳酸钠溶液发生反应,但在高温下能与碳酸钠固体发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在船舶的外壳装上铜块可防止其发生电化学腐蚀 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| C. | MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 | |
| D. | 用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
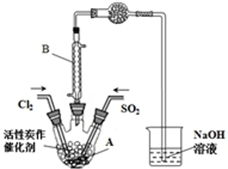 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示. | SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | … |
| … | C2H6 | C5H12 | C8H18 | … | … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com