
| A. | 86t | B. | 8.6t | C. | 4.3t | D. | 43t |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
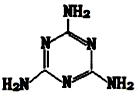 有机物三聚氰胺的结构如图所示:
有机物三聚氰胺的结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁生锈,负极反应式为Fe-3e-═Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2O2↑ | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用溴水鉴别植物油和己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{4x-2y}{a}$ | B. | $\frac{2x-y}{a}$ | C. | $\frac{8x-3y}{2a}$ | D. | $\frac{8x-3y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
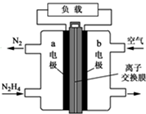 肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:
肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、氯化钾、硫酸钡 | B. | 氯水、次氯酸钠、乙醇 | ||
| C. | 液氯、胆矾、干冰 | D. | 重水、烧碱、水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com