
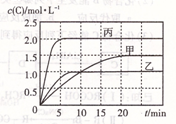
��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��xA(g)+B(g) 2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����±�����ͼ��ʾ �� ��
| ���� | �� | �� | �� |
| �ݻ� | 0.5L | 0.5L | 1. 0L |
| �¶ȣ� | T1 | T2 | T3 |
| ��Ӧ�� ��ʼ�� | 0.5molA 1.5 molB | 0.5 molA 1.5 molB | 2.0 molA 6.0 molB |
B
�������������A����ͼ��֪���ҷ�Ӧ���ʿ죬�¶ȸߣ�T1<T2������C��Ũ�ȵͣ��¶ȸ߷�Ӧ������У���ӦΪ���ȷ�Ӧ������B��������֪�ҡ���Ϊ��Чƽ�⣨���ɷ����������ͬ����������ѹǿ��ͬ������ֻ���Ƿ�Ӧ��ѧ��Ӧ����ʽ��������������ȣ���x=1������ɵ�K=0.8����ȷ��C��l0min�ڼ������з�Ӧ��ƽ������v(C)=0.1mol��(L��min)��1����v(B)=0.05mol��(L��min)��1������D��T1�棬����ʼʱ�������г���1.5molA��0.5molB�������0.5molA��1.5molB�ǵ�Ч�ģ�A��B��������ͬ��������ƽ��ʱC������Ϊ0.75mol����Ӧ��n(B)= n(C)��2=0.375mol������B��ת����Ϊ0.375��0.5=75%������
���㣺���黯ѧƽ����ƽ����ƶ���ƽ�ⳣ����ת���ʡ���Ӧ���ʵ��йؼ�������ݡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���¶��£�������ijһ��Ӧ��M��N������������ʵ����淴Ӧʱ��仯��������ͼ�����б�������ȷ��( )
A����Ӧ�Ļ�ѧ����ʽΪ��2M N N |
| B��t2ʱ�����淴Ӧ������ȣ��ﵽƽ�� |
| C��t3ʱ������Ӧ���ʴ����淴Ӧ���� |
| D��t1ʱ��N��Ũ����MŨ�ȵ�2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ���¶��µ��ܱ������з�����Ӧ��X(g)��3Y(g) 2Z(g) ��H��
2Z(g) ��H�� ����ͼ�Ƿ�Ӧ��ƽ�⼰�ı�����ƽ���ƶ���ͼ������˵���������
����ͼ�Ƿ�Ӧ��ƽ�⼰�ı�����ƽ���ƶ���ͼ������˵���������
A.c���d��X�����淴Ӧ�������
B.��ʼʱ������Y�����ʵ���Ϊ1.3mol
C.ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ����K(A)��K(B)
D.ƽ��״̬��A�䵽Bʱ���ų���������Q(A)��Q(B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
T Kʱ����2.0 L�����ܱ������г���1.0 mol COCl2����ӦCOCl2(g) Cl2(g)��CO(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
Cl2(g)��CO(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
| t / s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
N2(g)+3H2(g) 2NH3(g) ��H����92.4 kJ��mol-1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ������˵���������
2NH3(g) ��H����92.4 kJ��mol-1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ������˵���������
| A��ǰ20���ӷ�Ӧ�ڷų�������Ϊ46.2kJ |
| B����25���Ӹı�������ǽ�NH3�ӷ�Ӧ��ϵ�з����ȥ |
| C������60����ʱ��Ӧ�ִﵽ��ƽ�⣬��ʱ��ı�������ǽ����¶� |
| D��ʱ�������ʼͶ�ŵ�����Ũ������ԭ����2������Ӧ���ת��������ƽ�ⳣ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����Ϊ2 L�ĺ����ܱ������з�����ӦxA(g)+yB(g) zC(g)��ͼI��ʾ200��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ���ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A):n(B)�ı仯��ϵ�������н�����ȷ����
zC(g)��ͼI��ʾ200��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ���ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A):n(B)�ı仯��ϵ�������н�����ȷ����
A��200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v(B)=" 0." 02 mol��L��1��min��1
B��ͼ����֪��ӦxA(g)+yB(g) zC(g)�ġ�H<0����a=2
zC(g)�ġ�H<0����a=2
C������ͼ����ʾ��ƽ��״̬�£�������ϵ�г���He�����´ﵽƽ��ǰv(��)>v(��)
D��200��ʱ���������г���2 mol A ��1 mol B���ﵽƽ��ʱ��A ���������С��0.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij�¶������ݻ�������ܱ������У�����aX��g��+bY��g�� cW��g����Ӧ��������1 mol X��lmol Y���ﵽƽ��ʱ��W��Ũ��Ϊ0��2 mol/L������˵���������
cW��g����Ӧ��������1 mol X��lmol Y���ﵽƽ��ʱ��W��Ũ��Ϊ0��2 mol/L������˵���������
| A���ﵽƽ��ʱ������b mol Y��ͬʱ����c moI W |
| B���������¶ȣ�W�����ʵ���Ũ�ȼ�С����÷�Ӧ��H<0 |
| C������ʼͶ��X��Y�����ʵ����ֱ�Ϊamol��bmol����ƽ��ʱX��Y��ת������� |
| D������ͬ�����£��ٳ���l mol X��1 mol Y������ƽ��ʱ��W��Ũ��Ϊ0��4 mol/L����a+b>c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�������£��̶��ݻ����ܱ������з�Ӧ��2NO2(g) 2NO (g) +O2 (g) ��H��0���ﵽƽ�⡣���ı�����һ������X��Y��X�ı仯����ͼ�����ߵ���
2NO (g) +O2 (g) ��H��0���ﵽƽ�⡣���ı�����һ������X��Y��X�ı仯����ͼ�����ߵ���
| A����X��ʾ�¶�ʱ��Y��ʾNO2�����ʵ��� |
| B����X��ʾѹǿʱ��Y��ʾNO2��ת���� |
| C����X��ʾ��Ӧʱ��ʱ��Y��ʾ���������ܶ� |
| D����X��ʾNO2�����ʵ���ʱ��Y��ʾO2�����ʵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���¶��£���������˵�����淴ӦA��g��+2B(g)
 2C(g) �ﵽƽ��ģ� ��
2C(g) �ﵽƽ��ģ� ��
A�� �� �� �� �� ��Ũ��֮��Ϊ1:2:2 ��Ũ��֮��Ϊ1:2:2 |
B����λʱ�������� ��ͬʱ����2a mol C ��ͬʱ����2a mol C |
C��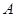 ��Ũ�Ȳ��ٱ仯 ��Ũ�Ȳ��ٱ仯 |
| D��������������ʵ���Ϊ2a mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com