(2009?南京二模)选做题,本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题作答,并把所选题目对应字母后的方框涂黑.若两题都作答,将按A题评分.
A.可以由下列反应合成三聚氰胺:
CaO+3C
CaC
2+CO↑ CaC
2+N
2CaCN
2+C↑ CaCN
2+2H
2O=NH
2CN+Ca(OH)
2,NH
2CN与水反应生成尿素[CO(NH
2)
2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
1s22s22p63s23p63d104s2或[Ar]3d104s2
1s22s22p63s23p63d104s2或[Ar]3d104s2
.CaCN
2中阴离子为CN
22-,与CN
22-互为等电子体的分子有N
2O和
CO2
CO2
(填化学式),由此可以推知CN
22-离子的空间构型为
直线形
直线形
.
(2)尿素分子中C原子采取
sp2
sp2
杂化.尿素分子的结构简式是
,其中碳氧原子之间的共价键是
C
C
(填字母)
A.2个σ键 B.2个π键 C.1个σ键、1个π键
(3)三聚氰胺(
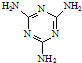
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
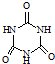
)后,三聚氰酸与三聚氰胺分子相互之间通过
分子间氢键
分子间氢键
结合,在肾脏内易形成结石.
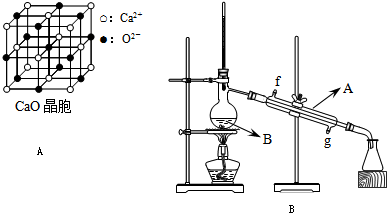
(4)CaO晶胞如图A所示,CaO晶体中Ca
2+的配位数为
6
6
.CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ/mol、NaCl 786kJ/mol.导致两者晶格能差异的主要原因是
CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量
CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量
.
B.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的物理性质如下表.请回答有关问题.
| 化合物 |
密度/g?cm-3 |
沸点/℃ |
溶解度/100g水 |
| 正丁醇 |
0.810 |
118.0 |
9 |
| 冰醋酸 |
1.049 |
118.1 |
∞ |
| 乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:
CH3CH2CH2CH2OCH2CH2CH2CH3
CH3CH2CH2CH2OCH2CH2CH2CH3
、
CH2=CHCH2CH3
CH2=CHCH2CH3
.
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:
用分水器及时移走反应生成的水,减少生成物的浓度;
用分水器及时移走反应生成的水,减少生成物的浓度;
、
使用过量醋酸,提高正丁醇的转化率
使用过量醋酸,提高正丁醇的转化率
.
Ⅱ.乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO
4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是
C
C
(填字母).
A.①②③④B.③①④②C.①④①③②D.④①③②③
(2)将酯层采用如图B所示装置蒸馏.
1.出图中仪器A的名称
冷凝管
冷凝管
.冷却水从
下
下
口进入(填字母).
2.②蒸馏收集乙酸正丁酯产品时,应将温度控制在
126.1℃
126.1℃
左右.
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率
79.4%
79.4%
.




 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(  )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过