
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是( )
A. 反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B. 上述转化中包含了氨气、硝酸、硝铵、小苏打、纯碱的工业生产方法
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
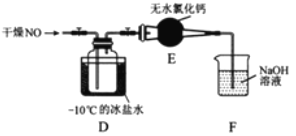
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修5:有机化学基础】具有抗菌作用的白头翁素衍生物H的合成路线如图所示

已知: ①.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
②.R﹣HC═CH﹣R′![]()
![]()
③.R﹣HC═CH﹣R′![]()

(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是____。C中官能团的名称是____。
(2)H的分子式为____,由G生成H的反应类型为____。
(3)试剂a的结构简式是____,试剂b为____。
(4)由C生成D的化学方程式是____。
(5)E与I2在一定条件下反应生成F的产物不唯一,此反应同时生成另外一种有机副产物且与F互为同分异构体,此有机副产物的结构简式是____。
(6)下列说法正确的是____。
A.E中含有3种官能团
B.1mol H与足量NaOH溶液反应,消耗2mol NaOH
C.由F生成G的反应是消去反应
D.1mol G最多可以与3mol H2发生加成反应
(7)与化合物C具有相同官能团且属于芳香族化合物的同分异构体共有____种(包括C本身)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( ) 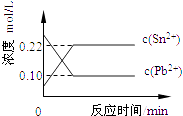
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 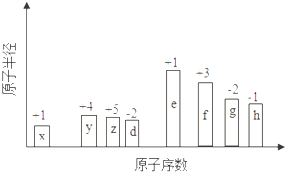
根据判断出的元素回答问题:
(1)y的元素名称 , 它位于元素周期表中第周期第族.
(2)h的最高价氧化物的化学式为 .
(3)d、g两种元素的最简单氢化物中稳定性比较强的物质,其结构式是 .
(4)x、z两元素可形成含有10个电子的分子,该分子的电子式为 . 位于第四周期且与z同主族的元素,其气态氢化物的化学式为 .
(5)e、f 两种元素最高价氧化物对应的水化物发生反应的离子方程式为 .
(6)将1mol e的单质在足量d 2中燃烧,所得产物中含有阴离子的数目为 , 含有的化学键为 . a.离子键 b.极性共价键 c.非极性共价键
(7)由x、d两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) . a.MnO2 b.FeCl3 c.Na2SO3 d.K2SO4 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)我国利用海水制盐具有悠久的历史。目前,从海水中制得的氯化钠除食用外,还是重要的工业原料,从海水中生产金属钠流程如下。
![]()
请回答:
(1)③中反应的化学方程式是_____________________。
(2)若为了得到精盐,除去粗盐中含有杂质泥沙、Mg2+、Ca2+、SO42-等,则制备精盐的正确的操作顺序是________(填字母)。
a.将粗盐溶解 b.过滤 c.蒸发 d.加入过量的碳酸钠溶液 e.加入过量的氯化钡溶液f. 加入过量的氢氧化钠溶液 g. 加入盐酸,调溶液的pH略大于7
(3)在(2)中d操作的目的是______________________。
(4)若要制备2.3吨金属钠,理论上需要含质量分数为90%氯化钠的粗盐的质量是___吨。
(二)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:

(1)三位同学制取氨气的化学方程式是:_________________。
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是______(填“甲”、“乙”或“丙”)。
(3)为确定试管内是否已收集满氨气,应将湿润的红色石蕊试纸置于收集气体的试管口处,若观察到____________________,则说明氨气已收集满。
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的的同学是______(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,2.0×10﹣3molL﹣1氢氟酸的水溶液中,调节溶液pH(忽略溶液体积变化)得到的[HF]、[F﹣]与溶液pH的变化关系如下图.下列叙述不正确的是( ) (提示:Ka(CH3COOH)=1.8×10﹣5molL﹣1 , Ksp(CaF2)=1.5×10﹣10mol3L﹣3)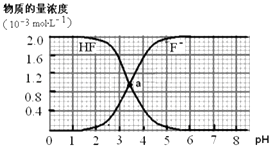
A.两条曲线交点a对应溶液的[F﹣]=[HF]
B.加入NaOH溶液至pH=7,溶液中[F﹣]=[Na+]
C.常温下HF的电离常数Ka(HF)>Ka(CH3COOH)
D.pH=4时,加入CaCl2固体使[Ca2+]=2.0×10﹣3molL﹣1 , 无CaF2沉淀析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com