
【题目】七叶树内酯的结构如下图,若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
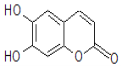
A. 2molBr2、2molNaOHB. 2molBr2、3molNaOH
C. 3molBr2、4molNaOHD. 4molBr2、4molNaOH
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下图,
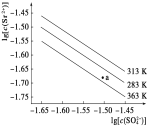
下列说法正确的是( )
A. 313K时,根据曲线计算可知Ksp(SrSO4) 数量级为10-5
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列 A、B、C、D 是中学常见的混合物分离或提纯的基本装置。
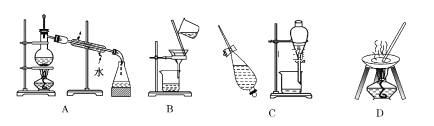
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将 A、B、C、D 填入适当的空格中。
(1)从碘水中提取碘____________________;
(2)分离酒精与水的混合物____________________;
(3)除去粗盐中的泥沙制精盐________________。
Ⅱ.实验室配制一定物质的量浓度溶液要用到量筒和图Ⅱ仪器等。配制某浓度的稀硫酸,用 10 mL 量筒量取浓硫酸的体积如图Ⅰ所示,

(1)A 与 B,B 与 C 刻度间相差 1mL,如果刻度 A 为8,量筒中浓硫酸的体积是________mL。
(2)要用 CuSO4·5H2O 晶体配制 480mL 0.1mol/L CuSO4 溶液,应该用托盘天平称取CuSO4·5H2O____
(3)图Ⅱ所示仪器的名称是_________仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、 “偏低”或“无影响”)
A.仪器中有少量蒸馏水______________;
B.定容时加水超过刻度线______________;
C.最终定容时俯视观察液面____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z 的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W____,X____,Y____,Z____。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是____;根据电子云重叠方式的不同,分子里共价键的主要类型有____。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是________(写化学式)。
(4)写出Z2Y2的电子式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
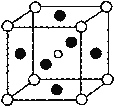
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度改变为1.5 mol·L-1
B. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
C. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2OCH3COOH+C2H5OH.已知该反应的速率随c(H+)的增大而加快。如图为CH3COOC2H5的水解速率随时间的变化图。下列说法正确的是( )

A. 反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B. A、B两点表示的c(CH3COOC2H5)相等
C. 图中t0时反应达到平衡状态
D. tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com