
| A. | CH3-CH=CH2和  | |
| B. | CH3CH2CHBrCH2Br 和CH3CHBrCH2Br | |
| C. | 苯与溴苯 | |
| D. | CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物;互为同系物的有机物分子中含有官能团的种类及数目一定完全相同,据此进行判断.
解答 解:A.两种物质结构不相似,不是同系物,故A错误;B.两者结构相似,含有官能团的个数相等,属于同系物,故B正确;C.苯是烃,溴苯是苯的衍生物,二者结构不相似,含有官能团也不相同,属于不同的物质,故C错误;D.前者为二烯烃,后者为炔烃,不是同系物,故D错误,故选B.
点评 本题主要考查了同系物的判断,题目难度不大,注意掌握 同系物的概念及判断方法,明确C3H6可能为烯烃,也可能为环烷烃,二者结构不一定相似.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO量不变 | C. | 氧气浓度不变 | D. | 平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
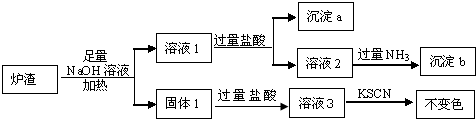
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始加入的C(s)与H2O(g)物质的量为2:1 | |
| B. | 若增大压强,H2O(g)转化率不变化 | |
| C. | 达到平衡后混合气体平均式量可能为16 | |
| D. | 开始反应后混合气体平均式量一直减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题:
已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题: .画出G离子的结构示意图
.画出G离子的结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com