
 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
分析 (1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)根据可逆反应的特点进行判断;
(4)根据等效平衡进行计算;
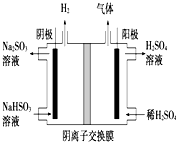
(5)阳极上阴离子失去电子发生氧化反应,且酸与亚硫酸氢根离子反应.
解答 解:(1)2SO2+O2 $?_{加热}^{催化剂}$2SO3,K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$,故答案为:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$;
(2)a.v正(O2)=2v逆(SO3),反应速率之比与化学计量数之比不等,故a错误;
b.平均分子量=$\frac{总质量}{总物质的量}$,总质量一定,总物质的量会变,故容器中气体的平均分子量不随时间而变化能说明到达平衡状态,故b正确;
c.随反应进行气体的质量不变,容器的体积也不变,故容器中气体的密度不随时间而变化不能说明到达平衡状态,故c错误;
d.随反应进行气体的分子数减少,故容器中气体的分子总数不随时间而变化能说明到达平衡状态,故d正确;
故答案为:bd;
(3)2SO2(g)+O2(g)?2SO3(g)的平衡体系中加入18O2,由于反应是可逆反应,所以达到新的平衡后18O2出现在SO2、O2与SO3中,故SO2中18O的百分含量增加,
故答案为:增加;该反应是可逆反应,在SO2和18O2反应生成S18O3的同时,S18O3又分解生成S18O2;
(4)2SO2(g)+O2(g)?2SO3
Ⅰ2mol 1mol 0
Ⅱa b c
当SO2和SO3的物质的量之和为2 mol时,才能保证反应初始SO2的物质的量为2mol,即a+c=2mol,此时要求O2为1mol,那么就有b+0.5c=1mol.
满足此两条件方可使平衡与原平衡为等效平衡,
故答案为:a+c=2;2b+c=2;
(5)阳极电极是氢氧根离子放电,阳极反应为4OH--4e-=2H2O+O2、HSO3--2e-+H2O=3H++SO42-,且部分亚硫酸氢根离子会和氢离子反应生成二氧化硫气体,
故答案为:4OH--4e-=2H2O+O2;O2、SO2.
点评 本题考查影响化学平衡移动的因素、平衡状态的判断、平衡常数表达式、等效平衡、电极反应式的书写等知识点,难度较大.要注意等效平衡的条件.


科目:高中化学 来源: 题型:选择题
| A. | 进入煤矿矿井时用火把照明 | |
| B. | 实验室在通风橱中制备氯气 | |
| C. | 将水倒入浓硫酸配制稀硫酸 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22gCO2气体中所含分子数大于0.5NA | |
| B. | 1LCO2和1LCO所含分子数相同 | |
| C. | 等质量的O2和O3,所含的原子数一定相等 | |
| D. | 1mol•L-1的NaOH溶液中Na+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 恒温恒压下,若混合气体密度不变,说明反应已达平衡 | |
| B. | 恒容时通入氩气,压强不变,正逆反应速率也不变 | |
| C. | 降低温度可以缩短反应达到平衡的时间 | |
| D. | 恒容时通入X2,平衡向正反应方向移动,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物均为金属氧化物 | |
| B. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| C. | 酸根离子中不可能含有金属元素 | |
| D. | 还原产物只有还原性,氧化产物只有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
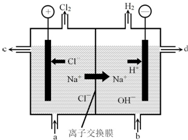 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com