
| A. | FeSO4溶液中含少量CuSO4杂质:加入过量的Fe粉,过滤 | |
| B. | 碳酸钠粉末中含有少量碳酸氢钠粉末:加热 | |
| C. | 除去FeCl3溶液中的FeCl2:加入氯水 | |
| D. | CO2中混有HCl气体:通入饱和的碳酸钠溶液 |
分析 A.Fe与硫酸铜反应生成硫酸亚铁和Cu;
B.碳酸氢钠加热分解生成碳酸钠;
C.氯化亚铁与氯气反应生成氯化铁;
D.二者均与碳酸钠溶液反应.
解答 解:A.Fe与硫酸铜反应生成硫酸亚铁和Cu,则加入过量的Fe粉,过滤可除杂,故A正确;
B.碳酸氢钠加热分解生成碳酸钠,则加热可除杂,故B正确;
C.氯化亚铁与氯气反应生成氯化铁,则加入氯水可除杂,故C正确;
D.二者均与碳酸钠溶液反应,不能除杂,应通入饱和的NaHCO3溶液除去CO2中混有HCl气体,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,注意除杂的原则,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器内混合气体的密度不随时间的变化而变化 | |
| B. | 单位时间内每消耗3mol H2,同时生成2mol NH3 | |
| C. | 混合气体的总质量不随时间的变化而变化 | |
| D. | 混合气体的总物质的量不随时间的变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
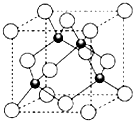 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
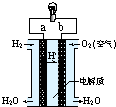
| A. | 电子由b通过灯泡流向a | |
| B. | 氢氧燃料电池是环保电池 | |
| C. | a极是负极 | |
| D. | 正极的电极反应是:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和苯酚均无毒,但都能用于消毒、杀菌 | |
| B. | 乙醇和苯酚均能和金属Na反应置换出氢气 | |
| C. | 苯酚能与甲醛反应制造酚醛树脂 | |
| D. | 乙醇的沸点比乙烷高是因为乙醇分子间可以形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
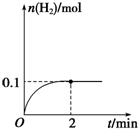 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
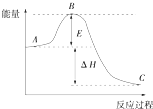 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用浓硝酸与Cu反应制取NO2 | B. | 用浓盐酸和MnO2反应制取Cl2 | ||
| C. | 用H2O2溶液和MnO2反应制取O2 | D. | 用NH4Cl和Ca(OH)2反应制取NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com