
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| c3(H2O)?c(CH3OH) |
| c2(CO2)?c6(H2) |
| c3(H2O)?c(CH3OH) |
| c2(CO2)?c6(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
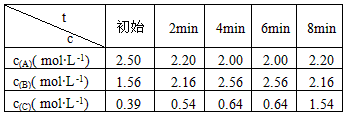
| t c |
��ʼ | 2min | 4min | 6min | 8min |
| c��A���� mol?L-1�� | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
| c��B���� mol?L-1�� | 1.56 | 2.16 | 2.56 | 2.56 | 2.16 |
| c��C���� mol?L-1�� | 0.39 | 0.54 | 0.64 | 0.64 | 1.54 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�����ѧ����10�½���ϰ��ѧ�Ծ����������� ���ͣ������
��12�֣���֪��N2O4(g) 2NO2(g) ��H��+52.70 kJ��mol��1��
2NO2(g) ��H��+52.70 kJ��mol��1��
��1���ں��¡����ݵ��ܱ������н���������Ӧʱ��������������˵���÷�Ӧ�Ѵ�ƽ����� ��
a��v(N2O4)����2 v(NO2)��
b�������������ƽ����Է�����������ʱ����仯
c��������������ܶȲ���ʱ����仯
d������������ķ�����������ʱ����仯
��2��t������£��ڹ̶��ݻ�Ϊ2L���ܱ������г���0.054 mol N2O4������Ӻ�ﵽƽ�⣬��������к�n(NO2)��0.06 mol����v(NO2) = ��t��ʱ��ӦN2O4(g) 2NO2(g)��ƽ�ⳣ��K= �����������ڼ���ͨ������N2O4����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ������)���ٴδﵽƽ���NO2��������� ԭƽ��ʱNO2���������(����ڡ�����С�ڡ����ڡ�)��
2NO2(g)��ƽ�ⳣ��K= �����������ڼ���ͨ������N2O4����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ������)���ٴδﵽƽ���NO2��������� ԭƽ��ʱNO2���������(����ڡ�����С�ڡ����ڡ�)��
��3��ȡ��ȷ�NO2���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�������Ӧ��2NO2(g) N2O4(g)����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ���(NO2%)�����������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ����������� ��
N2O4(g)����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ���(NO2%)�����������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ����10�½���ϰ��ѧ�Ծ��������棩 ���ͣ������
��12�֣���֪��N2O4(g) 2NO2(g) ��H��+52.70 kJ��mol��1��
2NO2(g) ��H��+52.70 kJ��mol��1��
��1���ں��¡����ݵ��ܱ������н���������Ӧʱ��������������˵���÷�Ӧ�Ѵ�ƽ����� ��
a��v(N2O4)����2 v(NO2)��
b�������������ƽ����Է�����������ʱ����仯
c��������������ܶȲ���ʱ����仯
d������������ķ�����������ʱ����仯
��2��t������£��ڹ̶��ݻ�Ϊ2L���ܱ������г���0.054 mol N2O4������Ӻ�ﵽƽ�⣬��������к�n(NO2)��0.06 mol����v(NO2) = ��t��ʱ��ӦN2O4(g) 2NO2(g)��ƽ�ⳣ��K=
�����������ڼ���ͨ������N2O4����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ������)���ٴδﵽƽ���NO2��������� ԭƽ��ʱNO2���������(����ڡ�����С�ڡ����ڡ�)��
2NO2(g)��ƽ�ⳣ��K=
�����������ڼ���ͨ������N2O4����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ������)���ٴδﵽƽ���NO2��������� ԭƽ��ʱNO2���������(����ڡ�����С�ڡ����ڡ�)��
��3��ȡ��ȷ�NO2���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�������Ӧ��2NO2(g) N2O4(g)����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ���(NO2%)�����������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ����������� ��
N2O4(g)����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ���(NO2%)�����������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ����������� ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com