
| A. | 试管外壁发热 | B. | 溶液最后变为蓝色 | ||
| C. | 溶液先变蓝最后褪色 | D. | 有气泡冒出 |
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
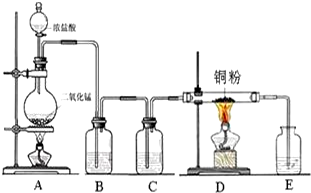 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
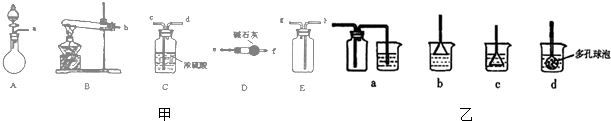
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 丙烷的球棍模型为 | |
| C. | 乙醇含有的官能团是-OH,带一个单位负电荷 | |
| D. | 乙酸的分子式:C2H4O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
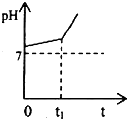 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ④⑤⑥ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
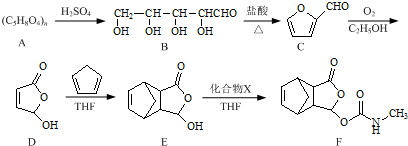
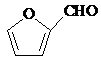 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$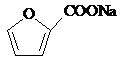 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.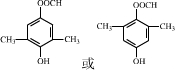 .
.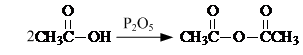 .
.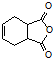 是合成抗病毒药阿昔洛韦的中间体,它可以用
是合成抗病毒药阿昔洛韦的中间体,它可以用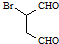 经氧化、消去、成酐一系列反应后再和原料M合成.
经氧化、消去、成酐一系列反应后再和原料M合成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别溶液中是否含有SO42- 时,先滴入稀盐酸使溶液酸化,再滴入氯化钡溶液 | |
| B. | 实验室用H2O2分解制O2,加入少量MnO2后,反应速率明显加快 | |
| C. | 为了加快制取NO气体的速度,可用浓硝酸代替稀硝酸与铜反应 | |
| D. | 检验溶液中是否含有NH4+,可加入足量NaOH溶液,加热,再用湿润的红色石蕊试纸伸入试管内检验是否变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com