
【题目】关于钠元素的单质及其化合物的叙述不正确的是( )
A. 钠是银白色金属,质软,熔点相对较低,密度比水小
B. Na2O2中阴阳离子个数比为1∶1
C. 金属钠在空气中长期放置,最终变为碳酸钠
D. Na2O和Na2O2都能由金属钠和氧气化合生成,但Na2O和Na2O2中O的价态不同
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,不一定说明木炭与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线,分析曲线得到的以下说法中,正确的是( )
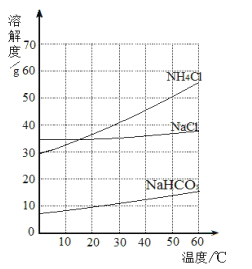
①冷却含有Na+、Cl-、NH4+、HCO3-的浓热的溶液,可得到碳酸氢钠晶体
②在20℃时,三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3
③在30℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2在工业、农业、医药上都有广泛的用途.
(1)H2O2是二元弱酸,写出第一步的电离方程式__,第二步的电离平衡常数表达式Ka2=_________.
(2)许多物质都可以做H2O2分解的催化剂.一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化).下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是________.
①I - ②Fe3+ ③Cu2+ ④Fe2+
(3)H2O2是一种环境友好的强氧化剂.电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+等)制备硫酸镍的一种流程如下:
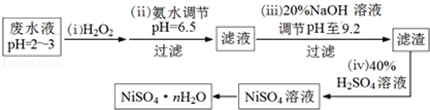
①第(ⅰ)步,加入H2O2反应的离子方程式_________________.
②为测定NiSO4nH2O的组成,进行如下实验:称取2.627g样品,配制成250.00mL溶液.准确量取配制的溶液25.00mL,用0.04000molL﹣1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2﹣=NiY2﹣+2H+),消耗EDTA标准溶液25.00mL.则硫酸镍晶体的化学式为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为CO(g)+H2O(g) ![]() H2(g)+CO2(g)。一定条件下,将4 mol CO与2 mol H2O(g)充入体积为2 L的密闭容器中,体系中各物质的浓度随时间的变化如图所示:
H2(g)+CO2(g)。一定条件下,将4 mol CO与2 mol H2O(g)充入体积为2 L的密闭容器中,体系中各物质的浓度随时间的变化如图所示:
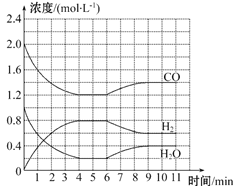
(1)在0~4 min时段,反应速率v(H2O)为_______mol·L-1·min-1,该条件下反应的平衡常数K为______(保留两位有效数字)。
(2)该反应到4 min时,CO的转化率为________。
(3)若6 min时改变的外部条件为升温,则该反应的ΔH________0(填“>”“=”或“<”),此时反应的平衡常数________(填“增大”“减小”或“不变”)。
(4)判断该反应达到化学平衡状态的依据是________。
a.混合气体的密度不变 b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆 d.断裂2 mol H—O键的同时生成1 mol H—H键
(5)若保持与4 min时相同的温度,向一容积可变的密闭容器中同时充入0.5 mol CO、1.5 mol H2O(g)、0.5 mol CO2和a mol H2,则当a=2.5时,上述反应向________(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 16gCH4中含氢原子数为4NA
B. 1mol·L﹣1NaCl溶液含有NA个Na+
C. 1molCu和足量稀硫酸反应产生H2分子数为NA
D. 常温常压下,22.4LCCl4中含有CCl4分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为___________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为_____________。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属_____________分子(选填“极性”“非极性”),其立体构型为_____________。
(3)橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂。该晶体属于_____________晶体。
(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图所示,分子内的作用力不可能含有_____________(填序号)。
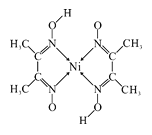
A离子键 B共价键 C金属键 D配位键 E氢键
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图所示,已知钨的摩尔质量为M g/mol,钨原子的半径为a pm。则钨的密度为ρ=_____________g·cm-3。(只需列出计算式,不需化简)
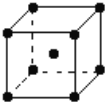
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是__,烧瓶中反应的化学方程式是__。
(2)装置B中盛放液体是__,气体通过装置B的目的是__。装置C中盛放的液体是__。
(3)D中反应的化学方程式是__。
(4)烧杯E中盛放的液体是__,反应的离子方程式是__。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关用途叙述错误的是( )
A. 碘化银为黄色固体,可用作人工降雨
B. 钠钾合金常温下为液体,可做快中子反应堆的导热剂
C. 钠还原性强,可从氯化物溶液中置换出钛钽铌锆等金属
D. 热的碳酸钠溶液可去除油污,碳酸氢钠常用于中和胃酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com