
【题目】配制一定物质的量浓度的Na2CO3溶液时,下下列因素会导致溶液浓度偏高的是
A. 溶解时有少量液体溅出 B. 洗涤液未全部转移到容量瓶中
C. 容量瓶使用前未干燥 D. 定容时液面未到刻度线
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关组成生物体化学元素的论述中,正确的是( )
A. 非生物界的元素在生物界都能找到,说明生物界和非生物界具有统一性
B. 人、动物与植物中所含的化学元素种类差异很大
C. 划分大量元素和微量元素的标准是元素的含量
D. 不同生物体内各种化学元素的含量比例基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式的书写。
①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式: 。
②已知化学方程式:H2(g)+O2(g)=![]() H2O(g),该反应的活化能为167.2kJ/mol,其逆反应的活化能为409.0kJ/mol,写出该反应的热化学方程式: 。
H2O(g),该反应的活化能为167.2kJ/mol,其逆反应的活化能为409.0kJ/mol,写出该反应的热化学方程式: 。
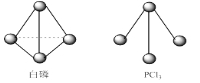
③已知白磷(P4)和PCl3的分子结构如图所示,现提供以下的化学键的键能(KJ/mol):P-P 198,Cl-Cl 243, P-Cl 331。则写出1mol白磷完全反应生成PCl3(s)时的热化学方程式:_____________.
④已知S(s)+O2(g)![]() SO2(g)当有4NA个电子转移时,放出297.23kJ的热量.写出该反应的热化学方程式 .
SO2(g)当有4NA个电子转移时,放出297.23kJ的热量.写出该反应的热化学方程式 .
⑤常温常压下,1克CH4完全燃烧生成CO2和H2O时,放出Q kJ的热量.写出此反应的热化学方程式: 。
⑥酒精燃烧的化学方程式为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l),完全燃烧一定量的无水酒精,放出的热量为Q kJ,当完全吸收生成的CO2,消耗8mol/L的NaOH溶液50mL时恰好生成正盐.写出此反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质中各元素的原子个数比是____________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为____________,该物质的分子式是____________。
(3)根据价键理论,预测A的可能结构并写出结构简式____________。
(二)结构式的确定:
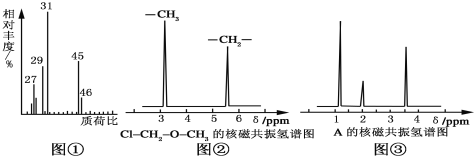
核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl2—CH2—O—CH3)有两种氢原子如图②。经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因: 。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是 (填字母序号)。
a.浓度均为0.1mol·L-1KHC2O4和K2C2O4的混合溶液中:2c(K+)=c(HC2O4-)+c(C2O42-)
b.0.1mol·L-1KHC2O4溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
c.0.1mol·L-1KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
d.0.1mol/LKHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
![]()
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
FeSO4·7H2O | (NH4)2SO4 | FeSO4·(NH4)2SO4·6H2O | |
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
用稀硫酸调溶液pH至1~2的目的是: , 。
趁热过滤的原因是: 。
氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M = 。(已知:部分反应产物为Mn2+、Fe3+、CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。

(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是 (填字母序号)。
a. 海洋中的氮循环起始于氮的氧化
b. 海洋中存在游离态的氮
c. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
d. 海洋中的反硝化作用一定有氧气的参与
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将离子方程式补充完整:
![]() NH4++5O2
NH4++5O2![]() 2NO2-+
2NO2-+![]() H++
H++![]() +
+![]()
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是 ,在最佳反应温度时,48 h内去除氨氮反应的平均速率是 mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。如图是间接氧化工业废水中氨氮(NH4+)的示意图。
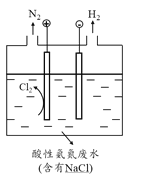
结合电极反应式简述间接氧化法去除氨氮的原理: 。
若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将 (填“增大”、“不变”或“减小”),请简述理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,在一定条件下发生反应2A(?)![]() B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则A为气态
B.若正反应是放热反应,则A为气态
C.改变压强对平衡的移动无影响
D.在平衡体系中加入少量C,则平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com