
【题目】NaHSO4和NaHCO3是常见的酸式盐,是水溶液中离子平衡部分重要的研究对象。请运用相关原理,回答下列有关小题。
(1)NaHSO4在水中的电离方程式为 。室温下,pH=5的NaHSO4溶液中水的电离程度 (填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为 (用离子方程式表示)。
(3)室温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH) c(SO![]() )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
(4)室温下,用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO![]() 完全沉淀,则反应后溶液的pH__________7(填“>”、”=”或“<”)。
完全沉淀,则反应后溶液的pH__________7(填“>”、”=”或“<”)。
(5)室温下,0.1 mol/L 的NaHCO3溶液的pH为8.4,同浓度的NaAlO2溶液的pH为12.4,同浓度的Na2CO3溶液的pH是11.4。
①将NaHCO3溶液和NaAlO2溶液等体积混合,可能发生的现象是 ,其主要原因是 (用离子方程式表示)。
②上述溶液中,由NaHCO3水解产生的c(OH-)是由 Na2CO3水解产生c(OH-)的 倍。
【答案】(1)NaHSO4=Na++H++SO42- =
(2)NH4++H2O![]() NH3·H2O+H+(3)>(4)>
NH3·H2O+H+(3)>(4)>
(5)①产生白色沉淀 AlO2-+ HCO3-+ H2O = Al(OH)3↓+CO32- ②10-3
【解析】
试题分析:(1)NaHSO4是强酸的酸式盐,在水中的电离方程式为NaHSO4=Na++H++SO42-。由于酸电离出的氢离子或碱电离出的氢氧根对水的电离均能起到抑制作用,且二者浓度相等时抑制程度相同,所以室温下,pH=5的NaHSO4溶液中水的电离程度=pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后生成硫酸钠、硫酸铵水水,铵根水解溶液显酸性,离子方程式为NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(3)室温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(H+)=c(OH-),根据得失守恒c(H+)+c(Na+)+c(NH4+)= c(OH-)+2c(SO42-)可知c(Na+)+c(NH4+)>c(SO42-)。
(4)室温下,用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后还有氢氧化钠生成,因此溶液的pH>7。
(5)室温下,0.1 mol/L 的NaHCO3溶液的pH为8.4,同浓度的NaAlO2溶液的pH为12.4,同浓度的Na2CO3溶液的pH是11.4。由于酸越弱相应的酸根越容易水解,溶液的碱性越强,所以酸性强弱顺序为Al(OH)3>NaHCO3>H2CO3。
①将NaHCO3溶液和NaAlO2溶液等体积混合,二者发生复分解反应生成氢氧化铝沉淀,因此可能发生的现象是产生白色沉淀,反应的离子方程式为AlO2-+ HCO3-+ H2O = Al(OH)3↓+CO32-。
②上述溶液中,由NaHCO3水解产生的c(OH-)是由 Na2CO3水解产生c(OH-)的![]() 倍。
倍。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内为加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
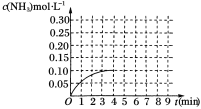
(1)根据上图,计算从反应开始到平衡时,平均反应速率υ(NH3)=___________ mol·L-1·min-1。
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填字母序号)。
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(3)该反应平衡常数K=____________。
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数____________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途的说法不正确的是
A. 磁性氧化铁可用于制备红色颜料和油漆
B. 氢氧化铝、碳酸氢钠可用于治疗胃酸过多
C. 钢罐可用于储运浓硫酸
D. SO2可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列各烷烃的分子式。
①烷烃A在同温同压下,蒸气密度是H2的43倍,则A为 。
②1 L烷烃C的蒸气完全燃烧时,生成同温同压下15 L的水蒸气,则C为___________。
③烷烃D分子中含有22条共价键,则D为_____________。
(2)相对分子质量为72的烷烃,若此有机物的一氯代物分子中有两个—CH3,两个—CH2—,一个![]() 和一个—Cl,它的可能结构有种 。
和一个—Cl,它的可能结构有种 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 糖类、油脂都属于高分子化合物 B. 淀粉水解产物一定是葡萄糖
C. 天然蛋白质水解产物均为α—氨基酸 D. 纤维、橡胶只能来源于工业生产
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017陆川县校级模拟】对实验①中和滴定;②中和热的测定;③实验室制备乙烯;④实验室用自来水制蒸馏水.下列叙述不正确的是( )
A.①④都要用到锥形瓶 B.②③都要用到温度计
C.③④都要用到酒精灯 D.①②都要用到指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图是自然界中氮的循环图,请分析此图并回答有关问题.
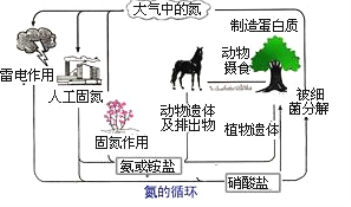
(1)大气中的氮以_____(填化学式)形式存在。图中共表示了_______种固氮的途径。
(2)由图可知,动植物体内的氮主要存在于蛋白质中,当动植物尸体发生腐败时,往往会产生一种含氮的气体,其电子式为___________。土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:K2S+KNO3+H2O![]() N2+K2SO4+KOH
N2+K2SO4+KOH
(3)上述反应中涉及1~18号元素的原子半径从大到小的顺序是_________________。属于共价化合物的反应物(或生成物)的结构式是_____________。
(4)配平上述反应方程式,并标出电子转移的方向和数目_____________。上述反应的氧化剂是_________________,被氧化的元素是____________________。
(5)上述过程的发生改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:_______________________。
(6)工业合成氨的简易流程如下图,通过循环Ⅰ可利用的气态物质是_____________

a.催化剂 b.只有N2 c.只有H2 d.N2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热下列物质的稀溶液,可能使离子总数减小的是(不考虑溶液的挥发)
A.Fe2(SO4)3 B.CH3COOH C.NaOH D.Ca(HCO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com