
【题目】如图所示的装置中,a是较活泼的金属,b是常温下化学性质很不活泼且能导电的碳棒。下列关于装置的叙述不正确的是( )
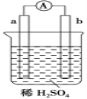
A. 碳棒上有气体产生
B. a是正极,b是负极
C. 导线中有电子流动,其流向为从a极到b极
D. a极上发生了氧化反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的个数是( )
①MgSO4溶液 ②NaCl溶液 ③CuSO4溶液 ④饱和澄清石灰水
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
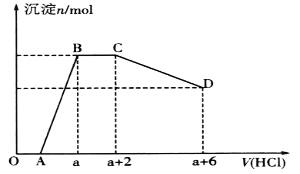
A. BC段是OH-与盐酸反应
B. 反应后最终溶液中的溶质只有NaC1
C. 原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为3:4
D. 原溶液中一定含有的离子是Na+、OH-、SiO32-、SO42-、[A1(OH)4]-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、有下列五种烃:①![]() ②
②![]() ③乙烷 ④戊烷 ⑤
③乙烷 ④戊烷 ⑤![]() ,其中互为同分异构体的是____________(填序号),②与⑤之间的关系为_____________,
,其中互为同分异构体的是____________(填序号),②与⑤之间的关系为_____________,
②③④⑤四种物质按它们的沸点由高到低的顺序排列正确的是_____________(填序号)
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
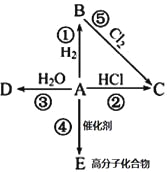
(1)写出A的电子式________,E的结构简式为______________
(2)写出下列反应化学方程式,并注明③⑤反应类型
② _____________________________________________
③ _____________________ ,反应类型________;
⑤ _____________________ ,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示:

下列说法不正确的是( )
A. 尿素水溶液热分解反应不属于氧化还原反应
B. 转化器工作过程中,当转移0.6mol电子时,会消耗4.48L NH3
C. 该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
D. 转化NO2过程的化学方程式为:8NH3+6NO2![]() 2N2+12H2O
2N2+12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 molA气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)═2C(g)。若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
A. ①③B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )

A. 两烧杯中溶液的pH均增大
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中铜片表面均无气泡产生
D. 产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,氢氧燃料电池以KOH溶液为电解质,其总反应的化学方程式为2H2+O2=2H2O。
(1)负极上的电极反应为______。
(2)消耗标准状况下的5.6LO2时,有____mol电子发生转移。
(3)工作过程中时,溶液的c(OH-)____(填“增大”、“减小”或“不变”)。
2.证明卤族元素的非金属性强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检查)。
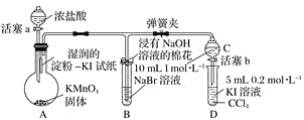
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________。
(2)B中溶液发生反应的离子方程式是________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是______。
(4)过程Ⅲ实验的目的是________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐___,得电子能力逐渐____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨氮(NH3、NH4+)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:![]()
![]()
![]()
![]() N2
N2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
A. 该废水大量直接排放,对水体的影响不大
B. 微生物脱氮时可在高温下进行,以加快脱氮的速率
C. 步骤a发生反应:NH4++2O2=NO3-+H2O+2H+
D. 化学沉淀法脱氮时,溶液的碱性过强,氨氮的去除率将下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com