
| A. |  测定中和反应的反应热 | B. | 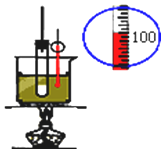 实验室制取硝基苯 | ||
| C. | 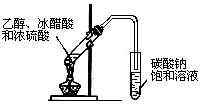 实验室制取乙酸乙酯 | D. | 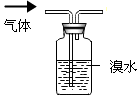 除去甲烷中混有的乙烯 |
分析 A.温度计测定温度,图中保温操作合理;
B.苯与浓硝酸、浓硫酸在50℃~60℃下发生硝化反应生成硝基苯;
C.乙醇与乙酸发生酯化反应生成乙酸乙酯,浓硫酸作催化剂、吸水剂,饱和碳酸钠可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
D.乙烯与溴水反应,而甲烷不能.
解答 解:A.温度计测定温度,图中保温操作合理,则图中装置可测定中和热,故A正确;
B.苯与浓硝酸、浓硫酸在50℃~60℃下发生硝化反应生成硝基苯,图中测定水温不合理,故B错误;
C.乙醇与乙酸发生酯化反应生成乙酸乙酯,浓硫酸作催化剂、吸水剂,饱和碳酸钠可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,则可制备乙酸乙酯,故C正确;
D.乙烯与溴水反应,而甲烷不能,则图中洗气装置可除杂,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握图中装置的作用、中和热测定、有机物的制备实验、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:推断题
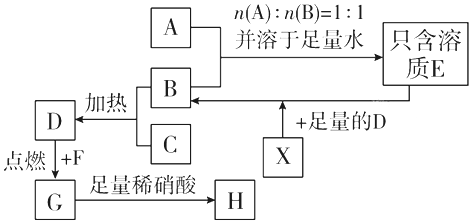
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | SiO2是碱性氧化物,能溶于酸,可用氢氟酸蚀刻玻璃 | |
| D. | 漂白粉长期暴露在空气中会变质失效 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和D2互为同素异形体 | B. | 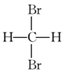 和 和  互为同分异构体 互为同分异构体 | ||
| C. | 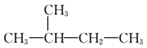 和 和 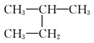 是同一种物质 是同一种物质 | D. | 乙醇的同分异构体是HO-CH2CH2-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
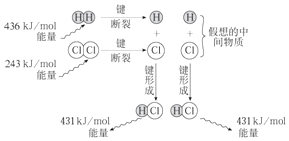
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学在实验室制取乙酸乙酯的主要步骤如下:
某同学在实验室制取乙酸乙酯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com