
| A. | Na2O2 | B. | KOH | C. | CaCl2 | D. | CO2 |
科目:高中化学 来源: 题型:选择题
| A. | c(X)=0.2mol?L-1 | B. | c(Y2)=0.35mol?L-1 | C. | c(Y2)=0.2mol?L-1 | D. | c(Z)=0.4mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含两个双键的直链有机物 | B. | 含一个三键的直链有机物 | ||
| C. | 含一个双键的环状有机物 | D. | 只含一个双键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
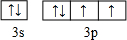
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| B. | 氨是制作氮肥、硝酸、铵盐的重要原料 | |
| C. | 将氢气和氯气混合光照生成氯化氢,溶于水制得盐酸 | |
| D. | 制造普通水泥的主要原料是黏土、石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | 相等浓度的CH3COONa、NaOH和NaHCO3三种溶液的pH:pH(CH3COONa)>pH (NaHCO3)>pH(NaOH) | |
| C. | 0.1mol•L-1的NaHA溶液,其pH=4:c(Na+)>c(HA-)>c(H+)>c(A2-)>c (H2A) | |
| D. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液成酸性:c(CH3COO-)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )| A. | 电流方向:电极Ⅳ→A→电极Ⅰ | B. | 电极Ⅰ发生还原反应 | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com