
| 改变条件 | 移动方向 | c(H+) | c(A-) |
| 升高温度 | |||
| 降低温度 | |||
| 加入HA | |||
| 加入H2O | |||
| 加浓硫酸 | |||
| 加NaOH | |||
| 加NaA |


科目:高中化学 来源: 题型:
| A、醋酸溶液与氢氧化钠溶液反应:H++OH-=H2O |
| B、碳酸钠溶液中加入氯化钙溶液:Ca2++CO32-=CaCO3↓ |
| C、硫酸铜溶液与氢氧化钡溶液混合 Cu2++2OH-═Cu(OH)2↓ |
| D、实验室用石灰石制取CO2:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl中H-Cl键的极性和HF中H-F的极性 |
| B、乙烯CH2=CH2中碳碳σ键的键能和碳碳π键的键能 |
| C、1mol金刚石晶体中C-C键数目和1mol SiO2晶体Si-O键数目 |
| D、MgCl2晶体的熔点与AlCl3晶体的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40 g NaOH溶解在1 L水中 |
| B、将200ml、2 mol?L-1HCl加水稀释配成2 L溶液 |
| C、将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL |
| D、将1 L 10 mol?L-1浓盐酸加入9 L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X有三种同位素 |
| B、其中一种同位素的质量为80 |
| C、X2的平均相对分子质量为159 |
| D、质量数为79的同位素的原子百分数为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
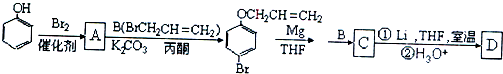

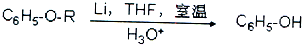
 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有 的有机反应类型
的有机反应类型
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、CO32-、I- |
| B、pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+ |
| D、所含溶质为Na2CO3的溶液:K+、Na+、NO3-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com