
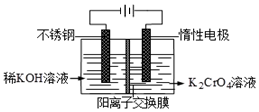
 已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.
已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.分析 ①K2Cr2O7在加热条件下可以氧化浓盐酸产生氯气,根据反应中元素化合价的升降相等配平离子方程式;
②由Ksp知Ag2CrO4更难溶,K2Cr2O7溶液显碱性,在碱性条件下Ag2Cr2O7最终转化成更难溶的Ag2CrO4,根据Ksp(Ag2CrO4),求出Ag+的物质的量浓度;
③依据电解原理分析,溶液中阴离子放电,氢氧根离子失电子发生氧化反应,氢离子浓度增大平衡正向进行,溶液呈橙色.
解答 解:①K2Cr2O7在加热条件下可以氧化浓盐酸产生氯气,其还原产物为Cr3+,K2Cr2O7中的Cr化合价由+6价变为Cr3+中的+3价,化合价变化3,Cl的化合价由-1价变为0价,化合价变化1,由于K2Cr2O7中Cr的数目为2,氯气中有2个氯原子,故K2Cr2O7的计量数为1,Cl-的计量数为6,反应的离子方程式为Cr2O72-+14H++6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O,
故答案为:Cr2O72-+14H++6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O;
②25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7,Ksp(Ag2CrO4)<Ksp(Ag2Cr2O7),形成沉淀时,Ag2CrO4所需Ag+浓度最小,即容易形成Ag2CrO4沉淀,Qc=c2(Ag+)×c(CrO42-)=1.12×10-12,c(Ag+)=$\root{3}{1.12×1{0}^{-7}}$≈3.35×10-3,
故答案为:3.35×10-3;
③阳极室发生氧化反应,氢氧根离子失去电子放电,电极反应为:4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+,阳极区氢离子浓度增大,平衡右移,溶液由黄色逐渐变为橙色,
故答案为:阳极产生无色气体,溶液由黄色逐渐变为橙色;4OH--4e-=O2↑+2H2O 或 2H2O-4e-=O2↑+4H+.
点评 本题考查离子方程式的书写、沉淀溶解平衡的计算、电化学等知识,掌握氧化还原反应原理、电解原理是解答关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
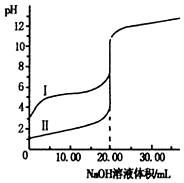 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A. | I、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | pH=7时,两种酸所消耗NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00mL时,c(Cl一)<c(CH3COO一) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应不是氧化还原反应 | B. | 氮气只是氧化产物 | ||
| C. | N2O4是还原剂 | D. | N2O4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于置换反应 | B. | 碳发生了还原反应 | ||
| C. | 二氧化硅是氧化剂 | D. | 24g碳充分反应生成28g硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com