
| A. | 滴加盐酸时,先产生沉淀又溶解 | |
| B. | 都能透过半透膜 | |
| C. | 加热、蒸干、灼烧,最终都有Fe2O3生成 | |
| D. | 都有丁达尔效应 |
分析 A.氯化铁溶液和盐酸不反应,胶体遇电解质溶液会聚沉;
B.胶体不能通过半透膜;
C.氯化铁中的三价铁水解生成氢氧化铁,加热水解更彻底,氢氧化铁受热易分解;
D.只有胶体具有丁达尔效应.
解答 解:A.氯化铁溶液中滴人盐酸,无现象,Fe(OH)3胶体中滴人盐酸,胶体会聚沉,先产生沉淀,然后氢氧化铁沉淀又溶解于盐酸中,故A错误;
B.胶体不能通过半透膜,溶液可以通过,故B错误;
C.氯化铁中的三价铁水解生成氢氧化铁,加热水解更彻底,产生沉淀,Fe(OH)3胶体加热会聚沉,生成氢氧化铁沉淀并且受热易分解,故C正确;
D.只有胶体具有丁达尔效应,溶液不具备,故D错误.
故选C.
点评 本题考查了胶体的性质以及胶体和溶液的区别,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
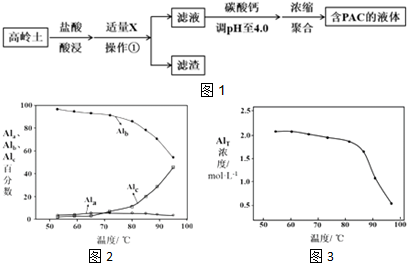
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | pH=1与pH=2的CH3COOH)溶液中,c(H+)浓度之比为1:10 | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4(g)+2O2(g)→CO2(g)+2H2O(g)+Q1 CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)+Q2 | |
| B. | S(s)+O2(g)→SO2(g)+Q1 S(g)+O2(g)→SO2(g)+Q2 | |
| C. | H2(g)+Br2(g)→2HBr(q)+Q1 H2(g)+Cl2(g)→2HCl(q)+Q2 | |
| D. | HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)+Q1 CH3COOH(aq)+NaOH(aq)→CH3COONa(aq)+H2O(l)+Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的主要原料是石墨,儿童使用时不会引起中毒 | |
| B. | CO有毒,生有煤炉的居室可放置数盆清水,能有效地吸收CO,防止煤气中毒 | |
| C. | “汽水”浇灌植物有一定的道理,其中CO2的释放,有利于植物的光合作用 | |
| D. | 硅的提纯与应用,促进了半导体元件与集成芯片业的发展,可以说“硅是信息技术革命的催化剂” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
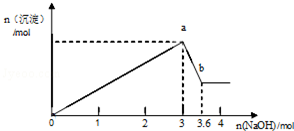 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com