

| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| A、涉及的离子方程式为:Cu+2Fe3+═2Fe2++Cu2+ |
| B、溶液中c(Fe3+):c(Cu2+)=4:3 |
| C、Cu片溶解了1.95g |
| D、此反应可应用于印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.
(1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.| 晶格能/kJ?mol-1 | 熔点/℃ | |
| CaO | 3401 | 2927 |
| KCl | 699 | 772 |
| KBr | 689 | 734 |
| KI | 632 | 680 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是制取溴苯的装置,试回答:
如图是制取溴苯的装置,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:
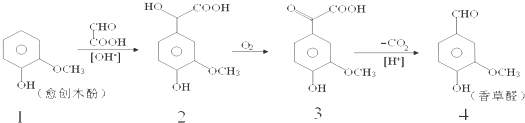
| A、反应1→2中原子利用率为90% |
| B、检验制得的香草醛中是否混有化合物3,可用氯化铁溶液 |
| C、化合物2在一定条件下可发生酯化反应 |
| D、等物质的量四种化合物分别与足量NaOH溶液反应,消耗NaOH物质的量之比1:4:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com