
| A. | NH3$→_{催化剂△}^{O_{2}}$NO$→_{H_{2}O}^{O_{2}}$HNO3 | |
| B. | 浓HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$\stackrel{电解}{→}$Al | |
| D. | 淀粉$→_{△}^{H_{2}SO_{4}(aq)}$葡萄糖$\stackrel{酒化酶}{→}$C2H5OH$→_{Ag,△}^{O_{2}}$CH3CHO |
分析 A.氨气催化氧化生成一氧化氮,一氧化氮和氧气按照4:3溶于水形成硝酸;
B.浓盐酸和二氧化锰加热反应生成氯气,氯气和石灰乳反应生成氯化钙、次氯酸钙和水,工业上用来制备漂白粉;
C.氧化铝溶于盐酸生成氯化铝溶液,氯化氢气流中蒸发结晶得到氯化铝固体,氯化铝是共价化合物,不能电解得到金属铝;
D.淀粉水解生成葡萄糖,葡萄糖在酒化酶作用下生成乙醇和二氧化碳,乙醇催化氧化生成乙醛.
解答 解:A.氨气催化氧化生成一氧化氮,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,一氧化氮和氧气按照4:3溶于水形成硝酸4NO+3O2+2H2O=4HNO3,能实现转化,故A不符合;
B.浓盐酸和二氧化锰加热反应生成氯气,MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气和石灰乳反应生成氯化钙、次氯酸钙和水,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,工业上用来制备漂白粉,能实现转化,故B不符合;
C.氧化铝溶于盐酸生成氯化铝溶液,氯化氢气流中蒸发结晶得到氯化铝固体,氯化铝是共价化合物,不能电解得到金属铝,不能实现转化关系,故C符合;
D.淀粉水解生成葡萄糖,(C6H10O5)+nH2O→nC6H12O6,葡萄糖在酒化酶作用下生成乙醇和二氧化碳,C6H12O6$\stackrel{酒化酶}{→}$2C2H5OH+2CO2↑,乙醇催化氧化生成乙醛,2CH3CH2OH+O2$→_{△}^{Ag}$2CH3CHO+2H2O,能实现转化,故D不符合;
故选C.
点评 本题考查了物质性质,主要是氮及其化合物、氯及其化合物、铝及其化合物、乙醇等物质性质的分析应用,掌握基础是解题关键,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
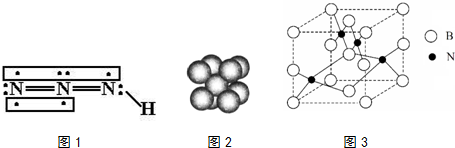
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
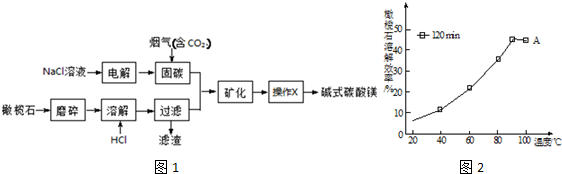
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
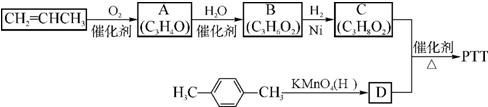
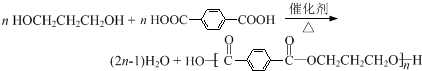 ,反应类型为缩聚反应.
,反应类型为缩聚反应. (须注明反应条件).
(须注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
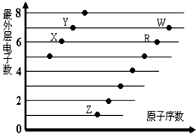
| A. | X与Z两种元素形成的化合物一定是离子化合物,有且只有离子键 | |
| B. | RX2、WX2、Z2X2都能使品红溶液褪色,且褪色原理相同 | |
| C. | R、W所形成的氧化物的水化物的酸性强弱为W>R | |
| D. | X、Y、R、W四种元素形成的气体氢化物中最稳定的是 Y 的气态氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
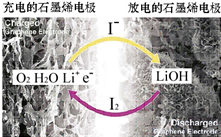 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )| A. | 充电时阴极反应为LiOH+e-═Li+OH | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH | |
| D. | 放电时负极上I- 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液中加入NaA固体后,$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | 常温下,0.1mol/LNaA溶液水解常数为10-9 | |
| D. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)═c(A-)+c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com