
| A. | 18 g冰的晶体中含有氢键的数目为2 NA | |
| B. | 11.2 L丙烷(标准状况)中含有σ键的数目为5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA | |
| D. | 1 mol C12与足量NaOH溶液反应,转移电子的数目为NA |
分析 A.依据n=$\frac{m}{M}$计算物质的量,氢键是分子间作用力;
B.气体体积转化为物质的量,1个丙烷分子中含有8个C-H键,2个C-C键;
C.NaAlO2溶液中偏铝酸根,水中都含有氧原子;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂.
解答 解:A.依据n=$\frac{m}{M}$计算物质的量=$\frac{18g}{18g/mol}$=1mol,氢键是分子间作用力,每个水分子形成两个氢键,18g冰中含有的氢键数目为2NA,故A正确;
B.11.2 L丙烷(标准状况)物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,含有σ键的数目为0.5mol×10×NA=5NA,故B正确;
C.2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目大于2NA,故C错误;
D.氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水,氯气既是氧化剂也是还原剂,1 mol C12与足量NaOH溶液反应,转移电子的数目为NA,故D正确;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意氯气与氢氧化钠反应中氯气表现性质,选项D为易错选项.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
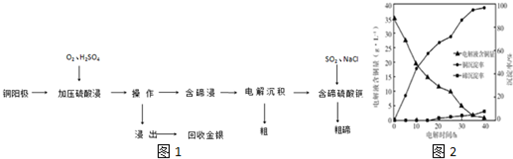
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
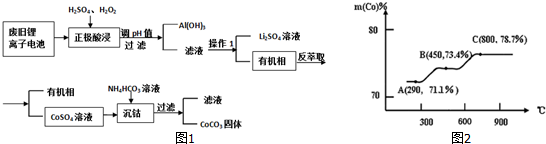
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
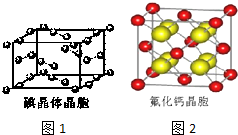 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
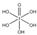 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水原理为:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 该溶液中AlO2-、F-、K+、Na+能大量共存 | |
| C. | 加入过量NH3•H2O反应的离子方程式为:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 加入过量Ba(OH)2溶液反应的离子方程式为:Al3++2SO42-+4OH-+2Ba2+=AlO2-十2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
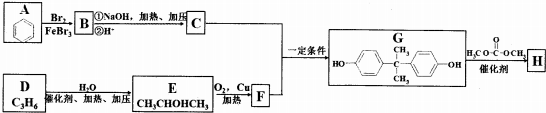
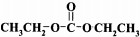 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$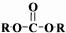 +2CH3CHOH(R为烃基)
+2CH3CHOH(R为烃基)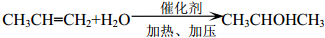 .
.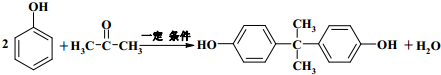 .
.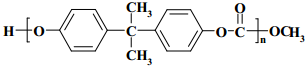 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
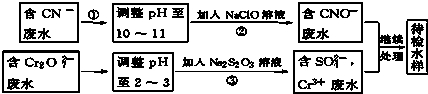
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com