
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)![]() 是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用氢氟酸、
是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用氢氟酸、![]() 和
和![]() 制备冰晶石。化学反应为
制备冰晶石。化学反应为![]() 。稳定性:HF______
。稳定性:HF______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,上述反应不能在玻璃容器中进行,其原因是________________
,上述反应不能在玻璃容器中进行,其原因是________________![]() 用化学方程式表示
用化学方程式表示![]() 。
。
(2)明矾![]() 常作净水剂。明矾溶液呈______
常作净水剂。明矾溶液呈______![]() 填“酸”“中”或“碱”
填“酸”“中”或“碱”![]() 性,向明矾溶液中滴加氢氧化钡溶液至
性,向明矾溶液中滴加氢氧化钡溶液至![]() 恰好完全沉淀,写出该反应的离子方程式: ______________。
恰好完全沉淀,写出该反应的离子方程式: ______________。
(3)铝合金材料耐酸、碱等腐蚀,广泛应用于生活、建筑等方面。工业上,常采用氧化法增厚铝合金材料表面的氧化膜,如常温下,用铬酸![]() 作氧化剂可以使氧化膜产生美丽的颜色
作氧化剂可以使氧化膜产生美丽的颜色![]() 还原产物为
还原产物为![]() ,配平化学方程式:______________
,配平化学方程式:______________![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() 。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等
。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等![]() 同温同压
同温同压![]() ,则该合金中铁、硅的质量之比为______。
,则该合金中铁、硅的质量之比为______。
【答案】![]()
![]() 酸
酸 ![]()
![]() ,2,1,1,2 4:1
,2,1,1,2 4:1
【解析】
![]() 氟的非金属性强于氧元素,由此可得出HF与H2O的稳定性关系,上述反应不能在玻璃容器中反应,其原因是氟化氢和二氧化硅反应;
氟的非金属性强于氧元素,由此可得出HF与H2O的稳定性关系,上述反应不能在玻璃容器中反应,其原因是氟化氢和二氧化硅反应;
![]() 明矾
明矾![]() 常作净水剂,是铝离子水解生成氢氧化铝胶体,由此可得出溶液的性质,向明矾溶液中滴加氢氧化钡溶液至
常作净水剂,是铝离子水解生成氢氧化铝胶体,由此可得出溶液的性质,向明矾溶液中滴加氢氧化钡溶液至![]() 恰好完全沉淀,由Al3+确定OH-的用量,再据Ba(OH)2的组成,确定SO42-的用量,从而写出该反应的离子方程式;
恰好完全沉淀,由Al3+确定OH-的用量,再据Ba(OH)2的组成,确定SO42-的用量,从而写出该反应的离子方程式;
![]() 铬酸
铬酸![]() 中Cr元素的化合价由
中Cr元素的化合价由![]() 降低到
降低到![]() ,Al的化合价由0价升高到
,Al的化合价由0价升高到![]() 价,根据化合价升降总数相等,配平氧化剂和还原剂的化学计量数,氧化产物和还原产物
价,根据化合价升降总数相等,配平氧化剂和还原剂的化学计量数,氧化产物和还原产物![]() 的化学计量数,再利用原子守恒配平水分子的化学计量数,从而得出反应化学方程式。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,与盐酸反应的为铁和铝,与氢氧化钠溶液反应的为铝和硅,铝产生氢气体积相等,则铁和硅生成的氢气相同,由此求出该合金中铁、硅的质量之比。
的化学计量数,再利用原子守恒配平水分子的化学计量数,从而得出反应化学方程式。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,与盐酸反应的为铁和铝,与氢氧化钠溶液反应的为铝和硅,铝产生氢气体积相等,则铁和硅生成的氢气相同,由此求出该合金中铁、硅的质量之比。
![]() 氟的非金属性强于氧元素,HF稳定性大于
氟的非金属性强于氧元素,HF稳定性大于![]() ,上述反应不能在玻璃容器中反应,其原因是氟化氢和二氧化硅反应,反应的化学方程式为:
,上述反应不能在玻璃容器中反应,其原因是氟化氢和二氧化硅反应,反应的化学方程式为:![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 明矾
明矾![]() 常作净水剂,是铝离子水解生成氢氧化铝胶体,溶液显酸性,所以明矾溶液呈酸性,向明矾溶液中滴加氢氧化钡溶液至
常作净水剂,是铝离子水解生成氢氧化铝胶体,溶液显酸性,所以明矾溶液呈酸性,向明矾溶液中滴加氢氧化钡溶液至![]() 恰好完全沉淀,该反应的离子方程式:
恰好完全沉淀,该反应的离子方程式:![]() ,
,
故答案为:酸;![]() ;
;
![]() 铬酸
铬酸![]() 中Cr元素的化合价由
中Cr元素的化合价由![]() 降低到
降低到![]() ,作氧化剂,Al的化合价由0价升高到
,作氧化剂,Al的化合价由0价升高到![]() 价,根据化合价升降总数相等,配平氧化剂和还原剂的化学计量数均为1,氧化产物和还原产物
价,根据化合价升降总数相等,配平氧化剂和还原剂的化学计量数均为1,氧化产物和还原产物![]() 的化学计量数均为
的化学计量数均为![]() ,再利用原子守恒配平水分子的化学计量数,反应化学方程式为:
,再利用原子守恒配平水分子的化学计量数,反应化学方程式为:![]() ,等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,与盐酸反应的为铁和铝,与氢氧化钠溶液反应的为铝和硅,铝产生氢气体积相等,则铁和硅生成的氢气相同,
,等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,与盐酸反应的为铁和铝,与氢氧化钠溶液反应的为铝和硅,铝产生氢气体积相等,则铁和硅生成的氢气相同,![]() ,
,![]() ,生成相同量的氢气,需要Fe物质的量和硅物质的量之比
,生成相同量的氢气,需要Fe物质的量和硅物质的量之比![]() ,质量比
,质量比![]() :
:![]() :1,
:1,
故答案为:2,2,1,1,2;4:1。


科目:高中化学 来源: 题型:
【题目】下列反应可用于合成CH3OH:
![]()
(1)Mn2+基态核外电子排布式为____________。
(2)与NO3-互为等电子体的分子为_______(写化学式)。
(3)CO32-的空间构型是________(用文字描述)。
(4)1molCH3OH中含有σ键的数目为______mol。CH3OH与H2O可以任意比互溶,除因为它们都是极性分子外,还因为________。
(5)锰元素的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()

A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如下所示。

已知以下信息:
①![]()
②![]() (R、R’代表烃基)
(R、R’代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y。
④化合物F的核磁共振氢谱图中只有一个吸收峰。
回答下列问题:
(1)X的含氧官能团的名称是______,X与HCN反应生成A的反应类型是________。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是________________。
(3)X发生银镜反应的化学方程式是______________________________________
(4)G在NaOH溶液中发生水解反应的化学方程式是_________________________
(5) 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)FeO·Cr2O3+NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
(2)完成下列反应_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:_______________。
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是________。
(5)用离子反应方程式表示泡沫灭火器的反应原理:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图微生物燃料电池结构示意图的说法:①微生物促进了电子的转移 ②微生物所在电极区放电时发生还原反应 ③放电过程中,H+从正极区移向负极区 ④正极反应式为:MnO2+4H++2e-===Mn2++2H2O正确的是( )
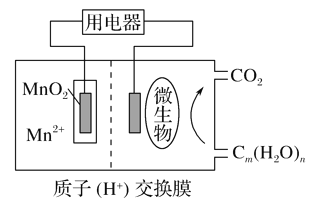
A. ④ B. ①③
C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
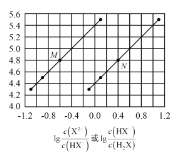
A.Ka2(H2X)的数量级为10-5
B.曲线N表示pH与lg![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)<c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是( )
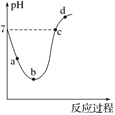
A. a点所示的溶液中c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
C. c点所示的溶液中c(Na+)=c(HClO)+c(ClO-)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的叙述正确的是( )
A.为确定![]() 是强酸还是弱酸,可测NaHA溶液的pH,若
是强酸还是弱酸,可测NaHA溶液的pH,若![]() ,则
,则![]() 是弱酸;若
是弱酸;若![]() ,则
,则![]() 是强酸
是强酸
B.![]() 时,在氨水体系中不断通入
时,在氨水体系中不断通入![]() ,随着
,随着![]() 的通入,
的通入,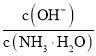 不断减少
不断减少
C.常温下。将等体积、等物质的量浓度的![]() 与NaC1溶液混合,析出部分
与NaC1溶液混合,析出部分![]() 晶体,过滤,所得滤液
晶体,过滤,所得滤液![]() ,则滤液中:
,则滤液中:![]()
![]()
D.室温下,将![]()
![]() 固体溶于水配成100mL溶液,向溶液中加入
固体溶于水配成100mL溶液,向溶液中加入![]() ,所得溶液中
,所得溶液中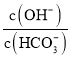 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com