
| A. | SiO2晶体中最小环上的原子数为6 | |
| B. | 在晶体中只要有阳离子就一定有阴离子 | |
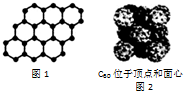
| C. | 12g石墨烯(如图1)中含有六元环的个数为0.5NA | |
| D. | 720g C60晶体(如图2)中含有0.5NA个晶胞结构单元 |
分析 A、二氧化硅晶体结构中,每个硅原子结合4个氧原子原子,同时每个氧原子结合2个硅原子原子,最小的环上,有6个Si原子和6个O原子,所以一共12个原子;
B、金属晶体中有阳离子但没有阴离子;
C、依据n=$\frac{m}{M}$计算物质的量=$\frac{12g}{12g/mol}$=1mol,石墨烯中平均每个六元环含碳原子2个,则1mol碳原子含有六元环的个数为0.5NA;
D、C60为分子晶体,如图中晶胞单元中,含有C60分子的个数为8×$\frac{1}{8}$=4,720g C60晶体中含有NA个C60分子,据此判断.
解答 解:A、二氧化硅晶体结构中,每个硅原子结合4个氧原子原子,同时每个氧原子结合2个硅原子原子,最小的环上,有6个Si原子和6个O原子,所以一共12个原子,故A错误;
B、金属晶体中有阳离子但没有阴离子,故B错误;
C、依据n=$\frac{m}{M}$计算物质的量=$\frac{12g}{12g/mol}$=1mol,石墨烯中平均每个六元环含碳原子2个,则1mol碳原子含有六元环的个数为0.5NA,故C正确;
D、C60为分子晶体,如图中晶胞单元中,含有C60分子的个数为8×$\frac{1}{8}$=4,720g C60晶体中含有NA个C60分子,所以720g C60晶体含有0.25NA个如图中晶胞单元,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数,注意根据晶体的结构分析晶体中含有的化学键数目,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式 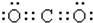 | |
| B. | Cl-的结构示意图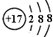 | |
| C. | NaOH的电子式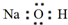 | |
| D. | 原子核内有20个中子的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | KCl | C. | CaCl2 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的比例模型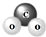 | |
| B. | 原子核内有10个中子的原子:${\;}_{8}^{16}$C | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | Cu基态的外围电子排布图: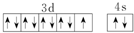 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 四氯化碳
四氯化碳 CO2
CO2 HClO
HClO 氯化铵
氯化铵 Na2O2
Na2O2

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
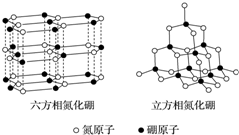 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )| A. | 六方相氮化硼与石墨一样可以导电 | |
| B. | 立方相氮化硼含有σ键和π键,所以硬度大 | |
| C. | 两种晶体均为分子晶体 | |
| D. | 六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com