
【题目】二氢弥猴桃内酯(J)是一种调配烟草用香精,制备该物质的合成路线如下:

已知:A、B、C中含有一种相同的官能团,B和C中均含有两个甲基。
(1)A的化学名称是_________;Ⅰ中所含官能团的名称是_________。
(2)A生成B或C的反应类型是_________,G生成H的反应类型是_________。
(3)A在催化剂作用下发生加聚反应,生成的常见高分子化合物的结构简式为_________。
D生成E所用的试剂为乌洛托品,其相对分子质量为140,可由甲醛与氨气以物质的量之比3∶2反应脱去水得到,乌洛托品分子中有4个六元环,所有氢原子化学环境相同,乌洛托品的分子式为_________,结构简式为_____________________________。
(4)化合物E与足量H2 在催化剂及加热条件下反应的化学方程式为________________________。
(5)芳香族化合物X是J 的同分异构体,1mol X能与2mol NaOH 反应,X的核磁共振氢谱有5组峰,且峰面积之比为1∶1∶2∶6∶6,写出一种符合条件的X的结构简式:__________________。
(6)写出以1-丙醇为原料(其他试剂任选)制备2-丁烯酸的合成路线____________________。
【答案】 2-甲基-1,3-丁二烯(或异戊二烯) 碳碳双键和羧基 加成反应 消去反应 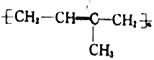 C6H12N4
C6H12N4 
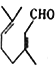 +3H2
+3H2![]()

 [或
[或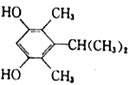 ] CH3CH2CH2OH
] CH3CH2CH2OH![]() CH3CH2CHO
CH3CH2CHO![]()
![]()
![]() CH3CH=CHCN
CH3CH=CHCN![]() CH3CH=CHCOOH
CH3CH=CHCOOH
【解析】A的分子式为C5H8,结合后面物质的结构可知为链烃,A、B、C中含有一种相同的官能团,B和C中均含有两个甲基,则官能团为碳碳双键,A为二烯烃CH2=C(CH3)CH=CH2,B和C分别为CH3CCl(CH3)CH=CH2和CH3C=(CH3)CH2CH3,B或C与A在四氯化锡催化下发生加成反应都生成![]() ,
,![]() 与乌洛托品反应生成
与乌洛托品反应生成![]() ,
,![]() 在苯胺、硫酸作用下转化为
在苯胺、硫酸作用下转化为![]() ,
,![]() 在乙酸、KCN作用下发生加成反应转化为
在乙酸、KCN作用下发生加成反应转化为![]() ,
,![]() 在POCl3、吡啶作用下发生消去反应转化为
在POCl3、吡啶作用下发生消去反应转化为![]() ,
,![]() 酸化得到
酸化得到![]() ,
,![]() 继续酸化得到
继续酸化得到![]() 。(1)A为CH2=C(CH3)CH=CH2,化学名称是2-甲基-1,3-丁二烯或异戊二烯;Ⅰ为
。(1)A为CH2=C(CH3)CH=CH2,化学名称是2-甲基-1,3-丁二烯或异戊二烯;Ⅰ为![]() ,所含官能团的名称是碳碳双键和羧基;(2)A生成B或C是CH2=C(CH3)CH=CH2与氯化氢发生加成反应生成CH3CCl(CH3)CH=CH2或CH3C=(CH3)CH2CH3,反应类型是加成反应,G生成H是
,所含官能团的名称是碳碳双键和羧基;(2)A生成B或C是CH2=C(CH3)CH=CH2与氯化氢发生加成反应生成CH3CCl(CH3)CH=CH2或CH3C=(CH3)CH2CH3,反应类型是加成反应,G生成H是![]() 在POCl3、吡啶作用下发生消去反应转化为
在POCl3、吡啶作用下发生消去反应转化为![]() ,反应类型是消去反应;(3) CH2=C(CH3)CH=CH2在催化剂作用下发生加聚反应,生成的常见高分子化合物的结构简式为
,反应类型是消去反应;(3) CH2=C(CH3)CH=CH2在催化剂作用下发生加聚反应,生成的常见高分子化合物的结构简式为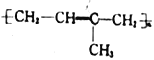 ;D生成E所用的试剂为乌洛托品,其相对分子质量为140,可由甲醛与氨气以物质的量之比3∶2反应脱去水得到,乌洛托品的分子中碳氮个数比为3:2,结构式为(C3HxN2)n,故估算应有n=2,则x=6,乌洛托品的分子式为C6H12N4;乌洛托品分子中有4个六元环,所有氢原子化学环境相同,则高度对称,乌洛托品的结构简式为
;D生成E所用的试剂为乌洛托品,其相对分子质量为140,可由甲醛与氨气以物质的量之比3∶2反应脱去水得到,乌洛托品的分子中碳氮个数比为3:2,结构式为(C3HxN2)n,故估算应有n=2,则x=6,乌洛托品的分子式为C6H12N4;乌洛托品分子中有4个六元环,所有氢原子化学环境相同,则高度对称,乌洛托品的结构简式为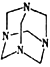 ; (4)化合物E(
; (4)化合物E(![]() )与足量H2在催化剂及加热条件下反应的化学方程式为
)与足量H2在催化剂及加热条件下反应的化学方程式为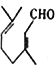 +3H2
+3H2![]()
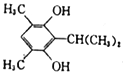
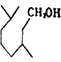 ;(5)芳香族化合物X是J的同分异构体,1molX能与2molNaOH反应,只含有二个氧故应该为两个酚羟基,X的核磁共振氢谱有5组峰,且峰面积之比为1∶1∶2∶6∶6,则两个酚羟基为其中的2,另各有两个等效甲基,即4个甲基分两组,高度对称,种符合条件的X的结构简式有:(9).
;(5)芳香族化合物X是J的同分异构体,1molX能与2molNaOH反应,只含有二个氧故应该为两个酚羟基,X的核磁共振氢谱有5组峰,且峰面积之比为1∶1∶2∶6∶6,则两个酚羟基为其中的2,另各有两个等效甲基,即4个甲基分两组,高度对称,种符合条件的X的结构简式有:(9).  或
或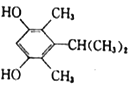 ; (6)1-丙醇在铜的催化下氧化得到丙醛,丙醛与KCN、乙酸发生反应生成
; (6)1-丙醇在铜的催化下氧化得到丙醛,丙醛与KCN、乙酸发生反应生成![]() ,
,![]() 在POCl3、吡啶作用下发生消去反应转化为CH3CH=CHCN,CH3CH=CHCN酸化得到2-丁烯酸,合成路线如下:CH3CH2CH2OH
在POCl3、吡啶作用下发生消去反应转化为CH3CH=CHCN,CH3CH=CHCN酸化得到2-丁烯酸,合成路线如下:CH3CH2CH2OH![]() CH3CH2CHO
CH3CH2CHO![]()
![]()
![]() CH3CH=CHCN
CH3CH=CHCN![]() CH3CH=CHCOOH。
CH3CH=CHCOOH。


科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100molL-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )

A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B. c(Na+)=0.100 molL-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C. c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 molL-1+c(HC2O4-)
D. pH=7的溶液中:c(Na+)=2c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. c(NH4+)相等的NH4Fe(SO4)2溶液、NH4HCO3溶液、(NH4)2SO4溶液,溶质浓度大小关系是:c[(NH4)2SO4] <c[NH4HCO3] <c[NH4Fe(SO4)2]
B. 常温下下,0.1mol/LHC1溶液与等体积0.1mol/LBa(OH)2溶液混合后,溶液的pH=13
C. 0.lmol/L的NaHCO3 溶液中,c(H+)+c(H2CO3)=c(CO32-)+c(OH- )
D. 用惰性电极电解饱和氯化钠溶液: 2C1-+2H+![]() H2↑+ Cl2↑
H2↑+ Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质混合后,不能生成NaOH的是
A.Na和H2OB.Na2O2和H2O
C.Ca(OH)2溶液和NaCl溶液D.Ca(OH)2溶液和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
四氧化三钴(Co3O4)纳米颗粒可以用于人造光合作用,以水和二氧化碳为原料制得甲醇燃料。回答下列问题:
(1)二氧化碳的水溶液中含有少量CO32-,CO32-的空间构型为____________。
(2)CO2,SiO2为同族元素的氧化物,SiO2熔点高的原因是__________________。
(3)甲醇分子中,中心原子的的杂化轨道类型为__________。甲醇易溶于水,其主要原因是____________________________________________________。
(4)Co3O4晶体结构中,O2-为立方紧密堆积;Co2+为四配位,填充于四面体空隙;Co3+填充于八面体空隙。Co2+的价层电子式为______;Co3O4晶体中Co3+的配位数为______。
(5)氧化亚钴与稀盐酸反应可生成紫红色六水合物(CoCl2·6H2O), 该反应的化学方程式为________________________________________________。
(6)四氧化三钴加热至900℃会分解生成氧化亚钴,氧化亚钴的晶体结构与氯化钠类似。若氧化亚钴晶体的晶胞边长为a pm,则两个紧邻的Co2+之间的距离为__________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以黄铜矿(主要成分是CuFeS2)为原料制备粗铜,进一步以粗铜为原料制备CuSO4·5H2O晶体。工艺流程如下(部分操作和条件略):
I. 煅烧黄铜矿,得到粗铜(含铁及铁、铜的化合物等);
II. 向粗铜中加入稀H2SO4和稀HNO3,并使产生的NO与H2O、O2反应;
III. 调节Ⅱ中所得溶液的pH,过滤;
Ⅳ. 将Ⅲ中滤液浓缩后冷却结晶,过滤,得到CuSO4·5H2O晶体。
已知:生成氢氧化物的pH
Cu(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.8 | 1.5 |
完全沉淀时 | 6.7 | 2.8 |
注:金属离子的起始浓度为0.1 mol/L
请回答:
(1)I中主要发生如下两个化学反应。请将反应ii的化学方程式补充完整。
i. 2CuFeS2+4O2![]() Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
ii. ![]() Cu2S+
Cu2S+![]() O2
O2 ![]()
![]() _________+
_________+ ![]() SO2
SO2
(2)II中NO与H2O、O2反应的化学方程式是_________。
(3)III中的滤渣主要是Fe(OH)3。调节溶液的pH时,pH范围是_________。
(4)有关上述过程的说法中,正确的是_________(填序号)。
a. I中尾气含有SO2,可综合利用制备H2SO4。
b. II中稀HNO3的作用之一是使Cu单质转化为Cu2+
c. 在上述过程中,HNO3可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在粗盐提纯的实验中,蒸发时正确的操作是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热
D.蒸发皿中出现大量固体时即停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。

(1)装置A中仪器a的名称为________。写出A中发生反应的离子方程式_________________________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理_______________________________________。
(2)选用图中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是__________________________________。
②丙同学设计的合理实验方案为:按照A→C→______→F→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是____________________________。
③其中裝置C的作用是____________________________。
(3)为了测定装置A残液中SO2的含量,量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL0.0500mol·L-1的KMnO4溶液吸收。充分反应后,再用0.2000 mol·L-1的KI标准溶液滴定过量的KMnO4,消耗KI溶液20.00mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为____g·L-1。
②若滴定前读数时平视,滴定终点读数时俯视则测定结果________(填“偏高”、“偏低”或“无影响”)。
【答案】 分液漏斗 CaSO3+2H+=Ca2++H2O+ SO2↑ SO2+2H2S=3S↓+2H2O 次氯酸在水溶液中能将SO2氧化,并非强酸制弱酸 B→E→D F中有沉淀后溶解,D不变色 除去挥发HCl 3.2 偏高
【解析】试题分析:(1)根据装置A分析仪器a的名称;A中亚硫酸钙与盐酸反应生成氯化钙、二氧化硫、水;SO2与H2S反应生成硫单质,能证明+4价的硫元素具有氧化性;(2)①次氯酸在水溶液中能将SO2氧化;②根据亚硫酸酸性大于碳酸、碳酸酸性大于次氯酸验证亚硫酸与次氯酸的酸性强弱;(3)①根据电子守恒计算SO2的含量;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小;
解析:(1)装置A中仪器a的名称分液漏斗;A中亚硫酸钙与盐酸反应生成氯化钙、二氧化硫、水,反应的离子方程式是CaSO3+2H+=Ca2++H2O+ SO2↑;SO2与H2S反应生成硫单质,能证明+4价的硫元素具有氧化性,反应方程式是SO2+2H2S=3S↓+2H2O;次氯酸在水溶液中能将SO2氧化,并非强酸制弱酸。所以按A→C→F→尾气处理顺序连接装置,不能证明亚硫酸和次氯酸的酸性强弱;②根据亚硫酸酸性大于碳酸、碳酸酸性大于次氯酸验证亚硫酸与次氯酸的酸性强弱;A中生成的SO2气体通过饱和NaHSO3溶液除去HCl,再通过饱和NaHCO3溶液生成二氧化碳气体,证明亚硫酸酸性大于碳酸,再通过高锰酸钾溶液除去CO2中的SO2,用品红溶液检验SO2已经除尽,再把CO2通入漂白粉溶液中,若D中品红不褪色、F中先有沉淀后溶解,证明碳酸酸性大于次氯酸;所以按照A→C→B→E→D→F→尾气处理(填字母)顺序连接装置。③其中饱和NaHCO3溶液的作用是除去挥发HCl。(3)①设10.00mL残液中SO2的质量是xg,根据电子守恒![]() ,x=0.032g,残液中SO2的含量为
,x=0.032g,残液中SO2的含量为![]() 3.2g·L-1;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小,根据上式可知测定结果偏高。
3.2g·L-1;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小,根据上式可知测定结果偏高。
【题型】实验题
【结束】
9
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题: (1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。 (2)写出步骤Ⅰ中反应的总化学方程式为___________________________________。 (3)简述步骤Ⅱ中能析出KClO3晶体而无其他晶体析出的原因是_____________________________。 (4)已知MgCl2溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。 (5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。 (6)步骤Ⅳ中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_____。 A.N2 B.H2 C. CO2 D.空气 (7)海水中溴含量为65mg·L-1。若1L海水中95%溴元素被氧化为Br2经热空气吹出,溴单质残留量3%。最后用SO2将90%Br2还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取气体的常用装置,请按要求填空:

(1)实验室用A装置制取氧气,反应的化学方程式为_________________。
(2)实验室制取二氧化碳,应选用的药品是________________(写名称),选择的发生装置是_________,选择此装置的理由_________________。
(3)F装置有多种用途。若在F中盛放_____________,可以干燥二氧化碳;若在F中充满水时,也可以作为氧气的收集装置,则氧气应从______端通入(填“a”或“b”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com