
如图,在试管甲中先加入3 mL乙醇和2 mL乙酸的混合物,然后一边摇动试管一边慢慢地加入2 mL浓硫酸,加入2~3块碎瓷片.然后将试管固定在铁架台上,在试管乙中加入5 mL饱和碳酸钠溶液,按图连接装置,用酒精灯对试管甲小心均匀地加热,当观察到试管乙中有明显现象时停止加热.试回答:

(1)试管乙中观察到的现象是________________.
(2)加入浓硫酸的目的是_____________________.
(3)该实验用到的球形管除冷凝作用外,另一重要作用是________.
(4)试管乙中饱和Na2CO3溶液的作用是_______________.
(5)写出试管甲中发生反应的化学方程式:____________.
科目:高中化学 来源: 题型:阅读理解
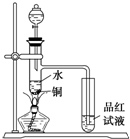 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| Cu或Ag |
| △ |
| Cu或Ag |
| △ |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
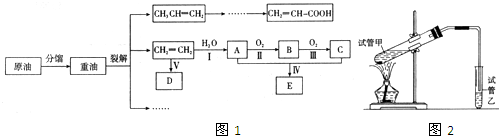
(15分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:?
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO40.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO410 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省哈三中高三9月月考化学试题 题型:填空题
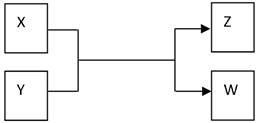
(15分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。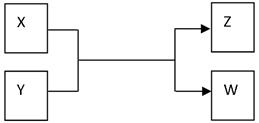
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:?
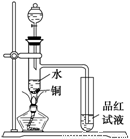
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO4 0.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。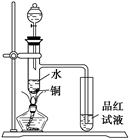
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省高三9月月考化学试题 题型:填空题
(15分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:?
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO4 0.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com