
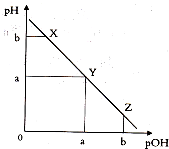
 某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )
某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )| A. | 此温度下,水的离子积常数为1.0×l0-2a | |
| B. | X点和Z点所示溶液中H2O的电离程度相同 | |
| C. | X、Y、Z三点所示的溶液中:c(NH4+)+c(H+)═c(Cl-)+c(OH-) | |
| D. | Y点消耗盐酸的体积等于氨水的体积 |
分析 A.Y点时pOH=pH,说明c(OH-)=c(H+)=l0-amol/L,水的离子积Kw=c(OH-)×c(H+);
B.X点溶液呈碱性,为NH4Cl、NH3•H2O混合溶液,X点溶液中氢离子源于水的电离,Z点溶液呈酸性,为NH4Cl、HC混合溶液,溶液中氢氧根离子源于水的电离;
C.溶液呈电中性,根据电荷守恒判断;
D.恰好反应得到NH4Cl溶液呈酸性,Y点的pH=pOH,溶液呈中性,氨水稍过量.
解答 解:A.Y点时pOH=pH,说明c(OH-)=c(H+)=l0-amol/L,水的离子积Kw=c(OH-)×c(H+)=1.0×l0-2a,故A正确;
B.点溶液呈碱性,为NH4Cl、NH3•H2O混合溶液,X点溶液中氢离子源于水的电离,Z点溶液呈酸性,为NH4Cl、HC混合溶液,溶液中氢氧根离子源于水的电离,而X点氢离子浓度与Z点氢氧根离子浓度相等,则X、Z点所示溶液中水的电离程度相同,故B正确;
C.溶液呈电中性,根据电荷守恒可知:c(NH4+)+c(H+)═c(Cl-)+c(OH-),故C正确;
D.恰好反应得到NH4Cl溶液呈酸性,Y点的pH=pOH,溶液呈中性,氨水稍过量,则Y点消耗盐酸的体积小于氨水的体积,故D错误.
故选:D.
点评 本题考查离子浓度大小比较、滴定曲线等,关键是理解pH与pOH关系以及与二者与溶液酸碱性关系,离子浓度等量关系比较中常考虑电荷守恒、物料守恒、质子恒等式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
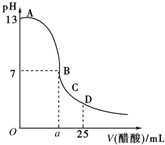 25℃时,在25mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是( )
25℃时,在25mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是( )| A. | B点的横坐标a=12.5 | |
| B. | C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

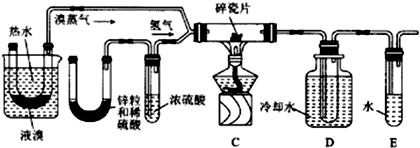
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑥ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
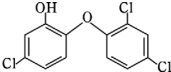 一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )
一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )| A. | 该物质苯环上的一溴取代物有 6 种 | |
| B. | 该物质与 FeCl3溶液混合后不显色 | |
| C. | 该物质中所有原子一定处于同一平面 | |
| D. | 物质的分子式为 C12H6Cl3O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: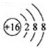 | |
| B. | NH4Cl的电子式: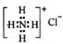 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ | |
| D. | 纯碱的化学式为NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com