
| �� | �� | �� | �� | �� | �� | �� | �� | |
| ԭ�Ӱ뾶/10-10m | 0.73 | 1.36 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.02 |
| �����ͻ��ϼ� | +2 | +1 | +5 | +7 | +1 | |||
| -2 | -3 | -2 |
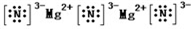


 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����



| ������I��eV�� | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ������ | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� |
| ԭ�Ӱ뾶��10-10m�� | 1.86 | 1.52 | 0.66 | 1.43 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
| ���̬ | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| ��ͼ�̬ | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
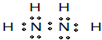
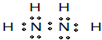
| ������I��Ev�� | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ������ | Ԫ�ر�� | |||||||
| A | B | C | D | E | F | G | H | |
| �⻯��ķе㣨�棩 | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| ����ϼ� | +6 | +5 | +4 | +5 | +7 | +4 | ||
| ��ͻ��ϼ� | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |




�鿴�𰸺ͽ���>>
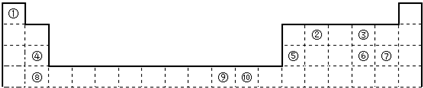
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���½�ũ��ʦ����ѧ�߶���ѧ����ĩ�����Ի�ѧ�Ծ����������� ���ͣ������
��6�֣��±�Ϊ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�ء�
��ش��������⣺
��1����������d����Ԫ�����������������ţ���
��2��д��Ԫ�آ�Ļ�̬ԭ�ӵĵ����Ų�ʽ����������������
��3��ijԪ�ص����������Ų�ʽΪnsnnpn��1����Ԫ��ԭ�ӵĺ����������ӵijɶԵ���Ϊ���������ԡ�
��4����3����8��Ԫ�ذ������۵�ߵ͵�˳����ͼ��������š�8������������������Ԫ�ط��ţ������е縺��������������������ͼ�е���ţ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com