
����Ŀ��ij�о���ѧϰС��Ϊ��̽������ĵ������������������ʵ�飺
��ʵ��һ�����Ʋ��궨������Һ��Ũ�ȡ�ȡ����������250 mL 0.2 mol��L��1�Ĵ�����Һ��Ȼ����0.2 mol��L��1�Ĵ�����Һϡ�ͳ�����Ũ�ȵ���Һ������NaOH����Һ����ϡ�͵Ĵ�����Һ��Ũ�Ƚ��б궨����ش��������⣺
��1������250 mL 0.2 mol��L��1������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�����������__________��
��2��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.200 0 mol��L��1��NaOH��Һ��20.00 mL������Һ���еζ������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ �����(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
�����ζ�ʱѡ��________(A.ʯ�B����̪��C������ָʾ�� D.����)Ϊָʾ��������ĸ��
���ô�����Һ��ȷŨ��Ϊ________(����С�������λ)��
��ʵ�����̽��Ũ�ȶԴ������̶ȵ�Ӱ�졣��pH�Ʋⶨ25 ��ʱ��ͬŨ�ȵĴ�����Һ��pH��������£�
����Ũ�� (mol��L��1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
��3�����ݱ������ݣ����Եó�������������ʵĽ��ۣ�����Ϊ�ó��˽��۵�������_________________��
��4���ӱ��е����ݣ������Եó���һ���ۣ����Ŵ���Ũ�ȵļ�С������ĵ���̶�______(��������������С������������)��
��ʵ������̽���¶ȶԴ������̶ȵ�Ӱ�졣
��5��Ҫ��ɸ�̽������Ҫ��pH��(��pH��ֽ)�ⶨ ___________________________��
����������Ӧ�á�
��6��ͨ��ʵ��ⶨ�����´����Ka��1��10��5����0.1 mol��L��1��������Һ��pH��________��
���𰸡� 250 mL����ƿ����ͷ�ι� B 0.200 0 mol��L��1 0.010 00 mol��L��1�����pH����2�����ϡ��10��ʱ��pH�ı仯ֵС��1 ���� ��ͬŨ�ȵĴ�����Һ�ڼ��ֲ�ͬ�¶�ʱ��pH 9
����������ʵ��һ����1������250 mL 0.2 mol��L��1������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�����������250 mL����ƿ����ͷ�ιܡ�
��2��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.200 0 mol��L��1��NaOH��Һ��20.00 mL������Һ���еζ�����ٵζ�ʱѡ��B (��̪)Ϊָʾ������Ϊ�ζ��յ���Һ�Լ��ԣ����̪�ı�ɫ��Χ���Ǻ����ڷ����������ݣ���ȥ���ϴ�ĵ�3��ʵ�����ݣ�ȡ����3�ε�ƽ��ֵ���м��㣬�ô�����Һ��ȷŨ��Ϊ0.200 0 mol��L��1��
��ʵ�������3�����ݱ������ݣ����Եó�������������ʵĽ��ۣ��ó��˽��۵�������0.010 00 mol��L��1�����pH����2�������ϡ��10��ʱ��pH�ı仯ֵС��1����
��4���ӱ��е����ݣ���0.200 0 mol��L��1�Ĵ���pHΪ2.83����0.0200 mol��L��1�Ĵ���pHΪ3.23������ϡ��10��ʱ��pH�ı仯ֵС��1��˵��������ˮ��Һ���е���ƽ����ڣ���ˮϡ��ʱ������ƽ�������ƶ������Ի����Եó���һ���ۣ����Ŵ���Ũ�ȵļ�С������ĵ���̶�����
��ʵ��������5�����ݿ��Ʊ�������Ҫ��ɸ�̽������Ҫ��pH��(��pH��ֽ)�ⶨ��ͬŨ�ȵĴ�����Һ�ڼ��ֲ�ͬ�¶�ʱ��pH��
��6��ͨ��ʵ��ⶨ�����´����Ka��1��10��5����0.1 mol��L��1��������Һ�д����ˮ������ӷ���ʽΪCH3COO-+H2O![]() CH3COOH+OH-��Kh=
CH3COOH+OH-��Kh=![]() = 1��10��9����ʱ��Һ��c(CH3COOH)��c(OH-)��Լ�����c(CH3COO-)ԼΪ0.1 mol��L��1�����⼸�����ݴ�����ʽ�����c(OH-)=1��10��5 mol��L��1���ٸ���KW���pH��9��
= 1��10��9����ʱ��Һ��c(CH3COOH)��c(OH-)��Լ�����c(CH3COO-)ԼΪ0.1 mol��L��1�����⼸�����ݴ�����ʽ�����c(OH-)=1��10��5 mol��L��1���ٸ���KW���pH��9��


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ġ��Ե�������ʽ���ڵĵ�Ԫ�أ���ʵ�����У��Ӻ�������ȡ������̺�ʵ��װ�����£� 
��1��д������ܶ�Ӧ��Ӧ�����ӷ���ʽ�� ��
��2������ܳ��˼������Cl2 �� �������������ѡ��������ţ���
A��Ũ���� B��H2O2��Һ C��KMnO4��Һ
������ ��
��3��������У�ijѧ��ѡ���ñ���ȡ��������� ��
��4�����һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ��Rԭ�ӵĺ�����������ں�������������Ԫ�ص���2.8 g��������ַ�Ӧ���ɵõ�6 g������RO2�������Ԫ��R�����ڱ��е�λ����(����)
A. �ڶ����ڵڢ�A�� B. �������ڵڢ�A��
C. �������ڵڢ�A�� D. �ڶ����ڵڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ������ ��
A. Ħ�����߸�����������֮һ B. �����ӵ�������û�е�λ��
C. 1molH2OԼ����6.02��1023 ��ˮ���� D. ������Ħ��������28g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ѵ����H������(����)
A. CH3COOH B. C2H5OH
C. H2O D. C6H5OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Al(OH)3��˵����ȷ����(����)
A.ֻ�������ᷴӦ
B.ֻ��������������Һ��Ӧ
C.���������ᷴӦ����������������Һ��Ӧ
D.�Ȳ��������ᷴӦ�ֲ���������������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.1molL��1 NaOH��Һ450mL���ش��������⣺ 
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����������ţ�������������Һ�����õ��IJ��������������������ƣ���
��2��������NaOH��Һʱ��
�ٸ��ݼ�����������ƽ��ȡNaOH������Ϊg��
����NaOH��Һ��ת��������ƿʱ����������������������ҺŨ��0.1mol/L�����������������=������
����NaOH�����ܽ��������������ƿ��ϴ�ձ���ϴ��Һ��������ƿ�����ݣ���������ҺŨ��0.1molL��1�����������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�����ǵ��͵Ŀɳ���أ������������Ƕ��Բ��ϣ�����ܷ�ӦʽΪ��
Pb��PbO2��4H����2SO![]()
![]() 2PbSO4��2H2O
2PbSO4��2H2O
��ش���������(�������⡢����������ԭ)��
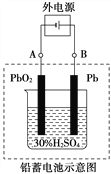
(1)�ŵ�ʱ�������ĵ缫��Ӧʽ��_______________________________��
���Һ��H2SO4��Ũ�Ƚ���__________�������·ͨ��1 mol����ʱ�������ϸ��������������__________����������ĵ��������ʵ���Ϊ__________��
(2)����ȫ�ŵ�ľ�PbO2��Pbʱ��������ͼ���ӣ����һ��ʱ�������A�缫������______��B�缫������_______����ʱǦ���ص���������ԭǦ���ص�������_______����������ͬ�������෴����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com