
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
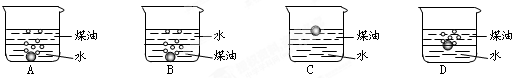
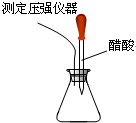 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
| B、在标准状况下,22.4L水的质量约为18g |
| C、22g二氧化碳与标准状况下11.2LHCl含有相同的分子数 |
| D、22.4L氮气含氮分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
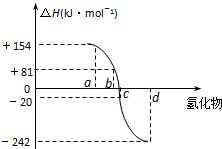 已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 35a |
| 22.4Vρ |
| 1000a |
| 22.4V |
| 17c |
| 1000w |
| A、①③ | B、②③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com