
【题目】在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L,c(Cl﹣)=0.2mol/L,则c(NO3﹣)为( )
A.0.05 mol/L
B.0.20 mol/L
C.0.30 mol/L
D.0.40 mol/L
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有____性。
(3)己知下列反应: ①2I-+2Fe3+=2Fe2+ +I2 ②2Fe2++H2O2+2H+=2Fe3++2H2O, 则Fe3+ 、I2 、H2O2三者的氧化性由强到弱为____________________________。
(4)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现的性质为_______ ,毎有1 molFe参加反应转移电子_____________mol。
(5)用双线桥标出该反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O电子转移的数目和方向______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运场馆 “水立方” 顶部和外部使用了一种新型膜材料,它与制作塑料袋的材料类型相同,都属于
A. 光导纤维B. 有机合成材料C. 金属材料D. 玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E、F、G在元素周期表中的位置如图1所示,回答下列问题:
(1)G的基态原子核外电子排布式为 . 原子的第一电离能:DE(填“>”或“<”).
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l﹣l>l﹣b>b﹣b(l为孤对电子对,b为键合电子对),则关于A2C中的A﹣C﹣A键角可得出的结论是 .
A.180°
B.接近120°,但小于120°
C.接近120°,但大于120°
D.接近109°28′,但小于109°28′
(3)化合物G(BC)5的熔点为﹣20℃,沸点为103℃,其固体属于晶体,该物质中存在的化学键类型有 , 它在空气中燃烧生成红棕色氧化物,反应的化学方程式为 .
(4)化合物BCF2的立体构型为 , 其中B原子的杂化轨道类型是 , 写出两个与BCF2具有相同空间构型的含氧酸根离子 .
(5)化合物EC的晶胞结构如图2所示,晶胞参数a=0.424nm.每个晶胞中含有个E2+ , 列式计算EC晶体的密度 gcm﹣3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法正确的是( ) 
A.甲池中阳离子向通入CH3OH一方的电极区域内移动
B.甲池通入CH3OH的电极反应式为CH3OH﹣6e﹣+2H2O═CO32﹣+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2 , 此时丙池中理论上产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的H2在同样条件下完全燃烧生成液态水,放出热量值为Q2,则Q1与Q2的关系为
A. Q1>Q2B. Q1=Q2C. Q1<Q2D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,所得的溶液中仍含有0.02mol的NaOH ,然后向溶液中逐滴加入lmol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
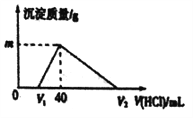
A. 原合金质量为0.92g B. 图中V2的值为60mL
C. 产生氢气的体积为1120mL D. 图中m的值为1.56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该_______________用来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是。_______________
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为:_______________。
④明矾能净水,其电离方程式是_______________。
(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(3)加热Al片的实验现象是_________________,原因是_____________。
【答案】 干沙子 K Al(OH)3 + 3H+ =Al3+ + 3H2O KAl(SO4)2 =K++ Al3+ + 2SO42- 2Na2O2 + 2CO2![]() 2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
【解析】(1)①钠着火生成过氧化钠,可与二氧化碳或水反应生成氧气,且钠与水反应生成氢气,若金属钠等活泼金属着火时,应该用干沙子灭火;②含K元素的物质焰色反应为浅紫色(透过蓝色钴玻璃);③氢氧化铝治疗胃酸(盐酸)过多的离子反应方程式为:Al(OH)3+3H+=Al3++3H2O;④明矾是KAl(SO4)212H2O,溶于水后得KAl(SO4)2溶液,在溶液中能完全电离为铝离子、钾离子和硫酸根,故电离方程式为:KAl(SO4)2═K++Al3++2SO42﹣;(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是2Na2O2 + 2CO2![]() 2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
【题型】填空题
【结束】
20
【题目】将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
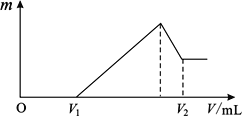
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=_______________mol;
(2)0~V1段发生的反应的离子方程式为_______________;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_______________mL;
(4)试计算V2的值: V2=_______________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com