
| A. | 荧光蛋白是一种高分子化合物且能发生水解 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 利用次氯酸钠溶液的碱性对餐具和环境消毒 | |
| D. | 大量排放PM2.5、SO2、NOX等会形成雾霾 |
分析 A.荧光蛋白是一种高分子化合物,含-CONH-;
B.纯碱与硫酸钙发生沉淀的转化,生成碳酸钙可溶于盐酸;
C.NaClO溶液具有强氧化性;
D.大量排放PM2.5、SO2、NOX等,污染空气.
解答 解:A.荧光蛋白是一种高分子化合物,含-CONH-,可发生水解反应,故A正确;
B.纯碱与硫酸钙发生沉淀的转化,生成碳酸钙可溶于盐酸,则用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙,故B正确;
C.NaClO溶液具有强氧化性,对餐具和环境消毒,与碱性无关,故C错误;
D.大量排放PM2.5、SO2、NOX等,污染空气,会形成雾霾,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、组成及发生的反应、环境保护等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 检验氯乙烷中的氯元素,水解后再用硫酸酸化 | |
| B. | 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化 | |
| C. | 为了抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 检验溶液中是否含有SO42-时,先用盐酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
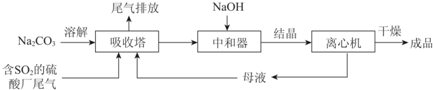
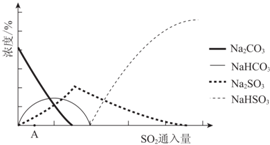
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁与稀盐酸反应:H++OH-═H2O | |
| B. | 氯化钡溶液与硫酸钠溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+ | |
| D. | 碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
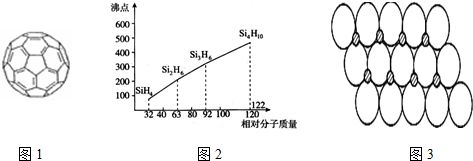
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
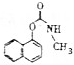 )在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(
)在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(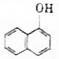 )合成西维因的反应:
)合成西维因的反应: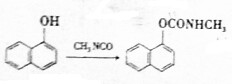
| A. | 该反应为加成反应 | |
| B. | 可用FeCl3溶液检验萘酚是否完全反应 | |
| C. | 萘酚与苯酚互为同系物 | |
| D. | 1mol西维因最多能与2molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com