


科目:高中化学 来源: 题型:
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为:2H2+O2===2H2O,负极反应为H2+CO-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
A.正极反应为2H2O+O2+4e-===4OH-
B.常温常压下每消耗22.4LH2向外电路提供的电子小于2mol
C.电子由正极经外电路流向负极
D.电池中CO的物质的量将逐渐减少
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省盘锦市高三第二次阶段考试化学试卷(解析版) 题型:选择题
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为2H2+O2===2H2O,负极反应为H2+CO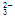 -2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
A.正极反应为2H2O+O2+4e-===4OH- B.CO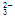 向负极移动
向负极移动
C.电子由正极经外电路流向负极 D.电池中CO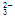 的物质的量将逐渐减少
的物质的量将逐渐减少
查看答案和解析>>
科目:高中化学 来源:2014届河北省高一下学期三调考试化学试卷(解析版) 题型:选择题
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为:2H2+O2===2H2O,负极反应为H2+CO-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
A.正极反应为2H2O+O2+4e-===4OH-
B.常温常压下每消耗22.4LH2向外电路提供的电子小于2mol
C.电子由正极经外电路流向负极
D.电池中CO的物质的量将逐渐减少
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省揭阳市高三毕业一模(理综)化学部分 题型:选择题
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为:
2H2 + O2 == 2H2O,负极反应为H2 + CO32--2e- = H2O + CO2。该电池放电时,下列说法中正确的是
A.正极反应为2H2O + O2 + 4e-= 4OH- B.CO32-向负极移动
C.电子由正极经外电路流往负极 D.电池中CO32-的物质的量将逐渐减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com