
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀盐酸 | 锌粒 | H2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,向2L恒容密闭容器中充入1molCOCl2(g)发生反应:COCl2(g)![]() Cl2(g)+CO(g),反应过程中测得的有关数据如下表:
Cl2(g)+CO(g),反应过程中测得的有关数据如下表:
t/s | 0 | 2 | 4 | 6 | 8 |
N(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是
A. 使用催化剂能够改变反应速率
B. 达到6s时,反应停止,不再进行
C. 在8s时,反应容器中各物质的浓度不再发生变化
D. 生成Cl2的平均反应速率,0~2s内平均速率比2~4s大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多变化中存在着能量的变化,请回答下列问题:
(1)从化学键角度上看,化学反应的本质是____________。
已知反应2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
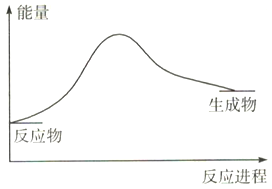
则反应中断裂的化学键是_______(用相应化学键的符号表示),该反应是_____(填“吸热”或“放热”)反应。4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
(2)写出一个属于吸热反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A. a和b用导线连接时,铁片上发生的反应为Fe-3e-===Fe3+
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b不连接时,铁片上会有金属铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 三聚氰酸(C3H3N3O3)的结构式为 ,它属于共价化合物
,它属于共价化合物
B. 只含H、N、O三种元素的化合物,可能是离子化合物,也可能是共价化合物
C. NaHCO3、CH3COONa均含有离子键和共价键
D. 化合物MgO、H2O中化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和煤制品(如水煤气、焦炭、甲醚等)已广泛应用于工农业生产中.
(1)已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ.mol﹣l
CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41.3kJ.mol﹣l
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 , 该反应在(填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)利用炭还原法可处理氮氧化物(如NO等),发生的反应为C(s)+2NO(g)N2(g)+CO2 (g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如表所示:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20min内,N2的平均反应速率可v(N2)= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.遁当缩小容器的体积
(3)研究表明,反应CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020molL﹣l , 在该条件下达到平衡时,CO的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A. 偏二甲肼的摩尔质量为60 g B. 1 mol 偏二甲肼的质量为60 g/mol
C. 1mol偏二甲肼的质量为60 g D. 6 g偏二甲肼(C2H8N2)含有NA个分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com