
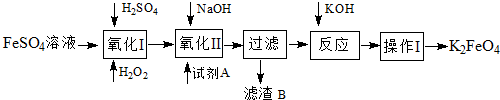
���� ���Ѱ������ĸ���ƷFeSO4�Ʊ�������أ����Ʊ����̿�֪��I������������������ⷢ��������ԭ��Ӧ���������ӣ�II�з���3NaClO+Fe2��SO4��3+10NaOH=2Na2FeO4��+3NaCl+3Na2SO4+5H2O�����˷����NaCl��Na2SO4���ټ�KOH����Na2FeO4+2KOH=K2FeO4+2NaOH������I�а�����ȴ�ᾧ������ϴ�ӡ����X�����裬ϴ��ѡ���Ҵ�����ֹ��������ܽ����ʧ���Դ������
��� �⣺��1���������У�����Fe3+�����ӷ�Ӧ����ʽΪH2O2+2H++2Fe2+=2Fe3++2H2O���ʴ�Ϊ��H2O2+2H++2Fe2+=2Fe3++2H2O��
��2��II�з���3NaClO+Fe2��SO4��3+10NaOH=2Na2FeO4��+3NaCl+3Na2SO4+5H2O����֪�������У��Լ�AΪNaClO�����˲����У��õ�������B�г�NaCl����Na2SO4��
�ʴ�Ϊ��NaClO�� Na2SO4��
��3������Ϣ���ܽ�ȿ�֪����ֹ��������ܽ⣬����ϴ�Ӳ���ʱӦ������ˮ�Ҵ�ϴ�ӣ��ʴ�Ϊ����ˮ�Ҵ���
��4����ˮʱ�������������ˮ��Ӧ������״��Fe��OH��3���ɵ��ӡ�����غ��֪��4K2FeO4+10H2O�T4Fe��OH��3��+8KOH+3O2����
�ʴ�Ϊ��4��10��4��8��3O2����
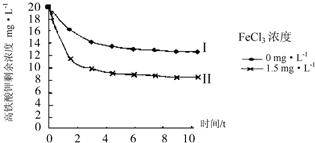
��5����ͼ��֪���Ȼ���Ũ��Խ��K2FeO4Ũ��ԽС����������ߢ�����ߢ�����ԭ����FeCl3��Һˮ�������ԣ��ٽ�K2FeO4��ˮ��Ӧ�Ӷ���K2FeO4Ũ�ȣ�
�ʴ�Ϊ��FeCl3��Һˮ�������ԣ��ٽ�K2FeO4��ˮ��Ӧ�Ӷ���K2FeO4Ũ�ȣ�
���� ���⿼�����ʵ��Ʊ�ʵ�飬Ϊ��Ƶ���㣬���������з����ķ�Ӧ�����������ᴿΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��������ԭ��Ӧ��ˮ���Ӧ�ã���Ŀ�ѶȲ���


 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��������ɸ�������ɺ����ʽ��з��࣬
��������ɸ�������ɺ����ʽ��з��࣬| ������� | �� | �� | �� | ���� ������ | ���� ������ |
| ��ѧʽ | ��H2SO4��H2SO3��HNO3��H2CO3 ��H2S | ��NaOH��KOH��NH3��H2O ��Ba��OH��2 | ��Na2CO3 ��Na2SO3��NaNO3��K2SO4��K2CO3��KNO3 | ��SO2 ��-- | ��-- ��-- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��

| A�� | ��Һ��pH=9ʱ����Һ�д������й�ϵ��c��HCO3-����c��NH4+����c��NH3•H2O����c��CO32-�� | |
| B�� | NH4HCO3��Һ�д��������غ��ϵ��c��NH4+��+c��NH3•H2O��=c��HCO3-��+c��CO32-��+c��H2CO3�� | |
| C�� | ��ͼ��֪��������Һ����εμ���������ʱNH4+��HCO3-Ũ����С | |
| D�� | ͨ��������֪������Ka1��H2CO3����Kb��NH3•H2O����Ka2��H2CO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��
̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | CO2 |
| H2O | CO | ||||
| 1 | 650 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | 2 | 0.4 | 0.4 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
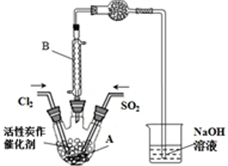 ��֪��SO2��g��+Cl2��g��+SCl2��g��?2SOCl2��g����H=-a kJ•mol-1
��֪��SO2��g��+Cl2��g��+SCl2��g��?2SOCl2��g����H=-a kJ•mol-1| SO2Cl2 | Cl2 | SO2 | |
| �۵�/�� | -54.1 | -101 | -72.4 |
| �е�/�� | 69.1 | -34.6 | -10 |
| ���� | ��ˮ��������ˮ�� | / | / |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HClO�Ľṹʽ��H-Cl-O | B�� | �������ӵı���ģ�� | ||
| C�� | ԭ�Ӻ�����10�����ӵ���ԭ�ӣ�18O | D�� | H2��H+��Ϊͬλ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com