
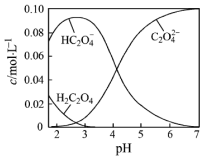
 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )| A. | pH=7的溶液中:c(Na+)>2c(C2O42-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | c(HC2O4-)=c(C2O42-)的点的坐标为(4.3,0.5),则Na2C2O4的水解平衡常数为Kh=1×10-9.7 |
分析 A.20℃时,pH=7的溶液中,显酸性,(H+)>c(OH-),根据电荷守恒判断;
B.依据溶液中电荷守恒和物料守恒分析,c(Na+)=0.100mol/L的溶液中c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-);
C.c(HC2O4-)=c(C2O42-)的溶液中c(Na+)<0.100 mol•;
D.Na2C2O4的水解平衡为C2O42-+H2O?HC2O4-+OH-,Kh=$\frac{c(O{H}^{-})c(H{C}_{2}{{O}_{4}}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$=c(OH-).
解答 解:A.20℃时,pH=7的溶液中,显酸性,(H+)>c(OH-),根据电荷守恒(H+)+c(Na+)=2c(C2O42-)+c(OH-),所以c(Na+)<2c(C2O42-),故A错误;
B.依据溶液中电荷守恒和物料守恒分析,c(Na+)=0.100mol/L的溶液中为NaHC2O4溶液,溶液中存在电荷守恒(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),物料守恒c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),代入计算得到c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-),故B正确;
C.c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1,c(HC2O4-)=c(C2O42-),电荷守恒(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),pH约4,此时氢离子浓度大于氢氧根,得到溶液中c(Na+)<0.100 mol•L-1+c(HC2O4-),故C错误;
D.c(HC2O4-)=c(C2O42-)的点的坐标为(4.3,0.5),c(H+)=10-4.3,Na2C2O4的水解平衡为C2O42-+H2O?HC2O4-+OH-,Kh=$\frac{c(O{H}^{-})c(H{C}_{2}{{O}_{4}}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4.3}}$=10-9.6,故D正确;
故选AC.
点评 本题考查了弱电解质的电离、离子浓度大小比较,侧重于学生的分析能力的考查,注意把握物料守恒、电荷守恒的运用,答题时注意体会,难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=12的NaAlO2溶液中,由水电离得OH-数目为0.01NA | |
| B. | 常温常压下,N2H4和CH3OH的混合物64g含有12NA个原子 | |
| C. | 0.1molCl2全部溶于水后转移电子的数目为0.1NA | |
| D. | 苯与液溴反应生成1mol溴苯,消耗0.5NA个Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中消耗O2 56 g | |
| B. | 所得产物中各物质的物质的量相等 | |
| C. | 若将产物通过碱石灰,不能被完全吸收 | |
| D. | 若将产物通过浓硫酸,充分吸收后,浓硫酸增重36g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下是一种无色无味的液体 | B. | 能与乙醇发生酯化反应 | ||
| C. | 不能与NaHCO3反应放出CO2 | D. | 能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子中碳碳键的键能是乙烷分子中碳碳键的2倍,因而乙烯比乙烷稳定 | |
| B. | 石油裂化的目的是为了将直链烃转化为芳香烃 | |
| C. | 分子式为C4H8O2的有机物,存在含有六元环的同分异构体 | |
| D. | 有机物  不能发生氧化反应,但可以发生消去反应、取代反应和加成反应 不能发生氧化反应,但可以发生消去反应、取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
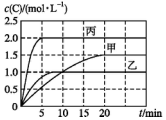 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T2℃时,丙容器比乙容器反应快的原因是使用了催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com