
【题目】有效去除废水中的H2SiF6、F-,改善水质是环境部门的重要研究课题。
(1)AlF3是有机合成中常用催化剂,利用废水中的H2SiF6可转变制得,相关的热化学方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l);ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq);ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l);ΔH=ckJ·mol-1
则反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH=__kJ·mol-1。
(2)废水的酸碱度及废水中的Fe3+对F-浓度的测定都会产生一定的影响。
①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是__。
②Fe3+与柠檬酸根(C6F5O73-)、F-反应可表示为Fe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-、Fe3++nF-
Fe(C6H5O7)n(3n-3)-、Fe3++nF-![]() FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是__。
FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是__。
(3)利用聚苯胺可吸附去除水中F-。用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程如图:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程如图:
![]()
写出阳极生成二聚体的电极反应方程式:___。
(4)利用MgCO3、Ca(OH)2和CaCO3等可沉淀去除废水中F-。
①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3,写出该反应的化学方程式:__。
②取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3。相同时间后溶液的pH及F-残留量如图1所示。实际废水处理过程中常选用MgCO3的理由是:__。
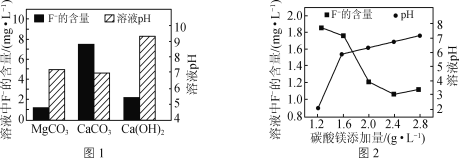
③改变碳酸镁添加量,处理后废水中F-含量及溶液pH的变化如图2所示。添加量超过2.4g·L-1后,F-含量略有升高的原因是___。{Ksp(MgF2)=7.4×10-11,Ksp[Mg(OH)2]=5.6×10-12}
【答案】![]() pH过小,H+与F-转化为弱酸HF Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力 2
pH过小,H+与F-转化为弱酸HF Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力 2![]() -2e-=
-2e-=![]() +2H+ MgCl2+CO(NH2)2+2H2O=MgCO3↓+2NH4Cl 相同条件下,使用MgCO3处理后的废水中F-残留量最低,溶液接近中性 碳酸镁的加入量增大后,导致溶液pH增大,使部分MgF2转化成Mg(OH)2
+2H+ MgCl2+CO(NH2)2+2H2O=MgCO3↓+2NH4Cl 相同条件下,使用MgCO3处理后的废水中F-残留量最低,溶液接近中性 碳酸镁的加入量增大后,导致溶液pH增大,使部分MgF2转化成Mg(OH)2
【解析】
(1)①3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l)△H=akJmol-1
②Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq)△H=bkJmol-1
③3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l)△H=ckJmol-1
根据盖斯定律计算(①+②+③×4)×![]() 得到反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的△H=
得到反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的△H=![]() kJmol-1;
kJmol-1;
(2)①pH过小,氢离子浓度过大,H+与F-转化为弱酸HF,;
②已知:Fe3++nC6H5O73-Fe(C6H5O7)(3n-3)-n、Fe3++nF-FeFn3-n,Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力,向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰;
(3)电解池中阳极失电子发生氧化反应,苯胺失电子生成二聚体,结合电子守恒和元素守恒可得电极反应为:2![]() -2e-=
-2e-=![]() +2H+;
+2H+;
(4)①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3和氯化铵,根据元素守恒配平书写化学方程式为:MgCl2+CO(NH2)2+2H2O=MgCO3↓+2NH4Cl,;
②据图可知相同条件下,使用MgCO3处理后的废水中F-残留量最低,溶液接近中性,所以实际废水处理过程中常选用MgCO3;
③已知Ksp(MgF2)=7.4×10-11,Ksp[Mg(OH)2]=5.6×10-12,二者为同种沉淀,所以氢氧化镁的溶解度要比氟化镁法溶解度稍小,碳酸镁的加入量增大后,导致溶液pH增大,使部分MgF2转化成Mg(OH)2。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,6.72LHCl气体溶于50mL水再配成250mL溶液,
(1)求溶质的物质的量_________
(2)求所得盐酸的物质的量浓度____________?
(3)若将此溶液再稀释成1.5 L溶液,求稀释后盐酸的物质的量浓度______________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染和温室效应。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的。
(1)脱硝:利用CH4催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=1160kJ·mol-1
CH4直接将NO2还原为N2的热化学方程为___。
(2)脱碳:将CO2转化为甲醇(CH3OH)的热化学方程式如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
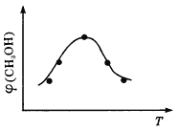
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述反应的ΔH3____0(填“>”“<”或“=”);
②在一个恒温恒容密闭容器中充入1molCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
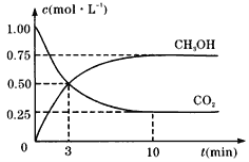
试回答:
0~10min内,CO2的平均反应速率为___mol·L1·min1;该温度下,反应的平衡常数的值为___(结果保留一位小数);第10min后,若向该容器中再充入1molCO2和3molH2,则再次达到平衡时CH3OH(g)的体积分数____(填“增大”、“减小”或“不变”)。
(3)脱硫:①某种脱硫工艺将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设参与反应的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为___。
②硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为___。在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+)___c(NO3)+c(OH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
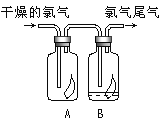
【题目】(1)氯气的实验室制法的化学方程式为________。如图所示,将氯气依次通过盛有干燥有色布条的广口瓶A和盛有潮湿有色布条的广口瓶B,可观察到的现象是______。
(2)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_________(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)实验室用如图所示装置制取氨气,收集氨气应使用___法;加热后将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是________,要得到干燥的氨气可选用___做干燥剂,除氨气外还可以用该装置制取的常见气体是_______。
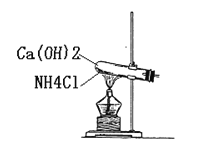
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁杉脂素是重要的木脂素类化合物,其结构简式如图所示。下列有关铁杉脂素的说法正确的是( )
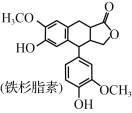
A.分子中有3个手性碳原子
B.能与甲醛发生缩聚反应
C.分子中所有的碳原子可能处于同一平面
D.1mol铁杉脂素与NaOH溶液反应最多消耗4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的单质、合金及其化合物用途非常广泛。
(1)Ni2+基态核外电子排布式为________。
(2)胶状镍可催化CH2=CHC≡N加氢生成CH3CH2C≡N。CH2=CHC≡N分子中σ键与π键的数目比n(σ)∶n(π)=________;CH3CH2C≡N分子中碳原子轨道的杂化类型为________。
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为______________________;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为______________________。
(4)一种新型的功能材料的晶胞结构如下图所示,它的化学式可表示为________。
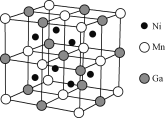
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______
(2)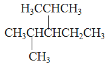 的名称为________
的名称为________
(3)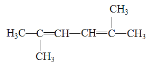 的名称为________
的名称为________
(4)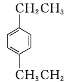 的名称为_______
的名称为_______
(5)![]() 的名称为________
的名称为________
(6)![]() 的名称为________
的名称为________
(7)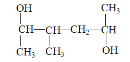 的名称为_______
的名称为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对NH4NO3的热分解产物提出如下4种猜想:
甲:N2、HNO3、H2O 乙:N2O、NO、H2O
丙:NH3、N2、H2O 丁:N2、NO、H2O
你认为猜想有科学性不正确的是( )
A.甲和乙B.乙和丁C.乙和丙D.丙和丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com