
VL含有(NH4)2SO4、NH4NO3的混合溶液,加入a mol NaOH后,加热,恰好使NH3全部逸出;又加入b mol BaCl2则刚好使SO42-完全沉淀,则原混合溶液中NH4NO3的物质的量浓度为( )
A. | B. | C. | D.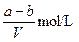 |
C
解析试题分析:根据混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则
SO42-+Ba2+=BaSO4↓
bmol bmol
根据加入a mol NaOH后,加热,恰好使NH3全部逸出,则
NH4+ + OH- NH3↑+H2O
NH3↑+H2O
amol amol
又因为溶液不显电性,所以由电荷守恒可知,原混合溶液中NH4NO3的物质的量为(a-2b)mol
所以硝酸铵的浓度是 ,所以答案选C。
,所以答案选C。
考点:考查物质的量浓度的计算
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生能力的培养和解题方法的指导与训练。明确发生的离子反应及溶液不显电性是解答本题的关键,并熟悉浓度的计算公式来解答即可。


科目:高中化学 来源: 题型:阅读理解
(1)预测:根据已有知识和“氢铵”的名称,该小组预测其中含有![]() ,并设计实验进行验证,同时设计实验探究该化肥中的阴离子。
,并设计实验进行验证,同时设计实验探究该化肥中的阴离子。
(2)①验证和探究①![]() 的验证:取少量固体药品于试管中,然后__________________。
的验证:取少量固体药品于试管中,然后__________________。
②阴离子的探究:取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。
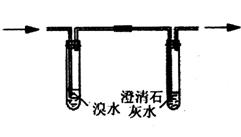
再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
结论:甲同学认为该化肥主要成分为(NH4)2CO3乙同学认为该化肥主要成分为NH4HCO3你认为该化肥主要成分为______________________。请你设计实验验证你的结论:
(3)该实验小组设计了以下两个实验方案测定该化肥的含氮量,请你阅读后进行评价:
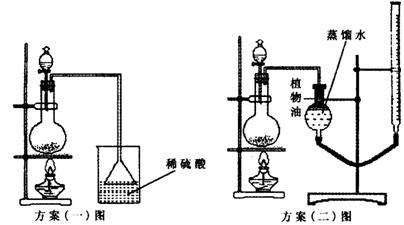
方案(一):准确称取一定质量的样品,放入上图方案(一)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量)。然后进行计算,可得化肥的含氮量。
方案(二):准确称量一定质量(设Ag)的样品,放入上图方案(二)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,测量生成的氨气体积(设所测体积为标况下体积)VL。然后进行计算,可得化肥的含氮量。
请你评价上述两套方案是否合理。若合理只需说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
方案(一):_________________________________________________________。
方案(二):_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com