
| A. | 926kJ | B. | 463 kJ | C. | 402.5kJ | D. | 23115 kJ |
分析 根据化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,结合反应方程式进行计算.
解答 解:已知2g氢气完全燃烧生成水蒸气时放出热量242kJ,则2mol氢气完全燃烧生成水蒸气时放出热量484kJ,
设水蒸气中1mol H-O键形成时放出热量xKJ,
化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,根据方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知:484kJ=4x-(436kJ×2+496KJ),
解得x=463KJ,
故选B.
点评 本题考查学生化学反应中的能量变化知识,题目难度不大,注意根据反应热与键能的关系计算,试题培养了学生的分析能力及化学计算能力.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中:
I氮是地球上极为丰富的元素,氮及其化合物与人们的生活息息相关.在氮的单质和常见化合物中: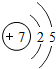 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
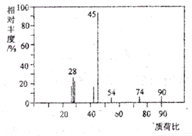 有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:
如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
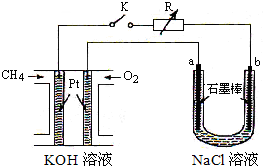 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行氯化镁溶液电解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行氯化镁溶液电解实验,电解装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com