
| A、反应后的溶液中不含Fe2+ |
| B、放出的NO气体的体积在标准状况为2.24L |
| C、稀硝酸的物质的量浓度为0.2mol?L-1 |
| D、所得溶液中Fe2+和Fe3+的物质的量之比为4:1 |
| 2.2g |
| 30g/mol |
| 5.6g |
| 56g/mol |
| 0.22mol |
| 0.1mol |
| 2.2g |
| 30g/mol |
| 5.6g |
| 56g/mol |
| 0.22mol |
| 0.1mol |
|
| 2.2g |
| 30g/mol |
| 2.2g |
| 30g/mol |
| 0.293mol |
| 1L |


科目:高中化学 来源: 题型:
 常温下,0.2mol?L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是( )
常温下,0.2mol?L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是( )| A、HA为弱酸 |
| B、该混合液pH>7 |
| C、图中X表示HA,Y表示OH-,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、①②③④ |
| C、④⑤⑥⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 | 5.4 |
| 完全沉淀 | 3.2 | 9.7 | 6.7 | 8.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
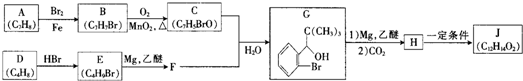

| 反应条件1 |
| 反应条件2 |
| (1)HCHO |
| (2)H2O |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32- |
| B、NH4+ |
| C、NO3- |
| D、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
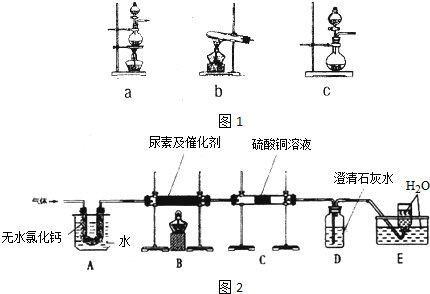
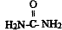 )做还原剂还原氮氧化合物是目前处理汽车尾气的一种方法,现设计实验模拟该过程并检验或收集其反应产物.
)做还原剂还原氮氧化合物是目前处理汽车尾气的一种方法,现设计实验模拟该过程并检验或收集其反应产物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com