
【题目】下列有关物质的说法正确的是
A.玻璃、陶瓷、水泥、光导纤维的化学组成都是硅酸盐
B.液氨汽化时要吸收大量的热,可用作制冷剂
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.生石灰能与水反应,可用来干燥氯气
科目:高中化学 来源: 题型:
【题目】在氯碱工业中,原料盐中的杂质离子危害很高,能破坏离子膜,以下对Ca2+、Mg2+、Fe3+、SO42-除去顺序不合理的是 ( )
A.BaCl2、NaOH、Na2CO3
B.BaCl2、Na2CO3、NaOH
C.NaOH、BaCl2、Na2CO3
D.Na2CO3、BaCl2、NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是医药上常用的一种药剂,合成路线如图所示。其中A是相对分子质量为58的链状烃,其核磁共振氢谱上的峰面积之比为9:1,G为五元环状有机化合物。
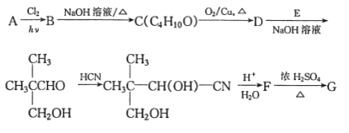
已知:①R'-CH2-CHO+RCH2-CHO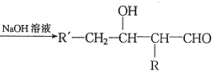
②RCN在酸性条件下水解变成RCOOH
(1)D分子中含有的官能团名称是___________。
(2)B→D反应过程中涉及的反应类型有_______________。
(3)A的结构简式为___________;E的结构简式为______________。
(4)F→G的化学方程式为____________。F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为_____________。
(5)同时满足下列条件G的同分异构体有_______种。(不包括立体异构)
①能发生银镜反应; ②能与NaHCO3发生反应。
其中核磁共振氢谱为4组峰的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲酸钙易溶于水。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下实验。
(1)在右图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热20分钟后冷却至室温。
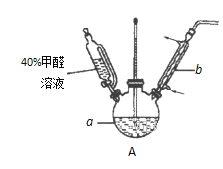
①仪器a的名称是_____________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。
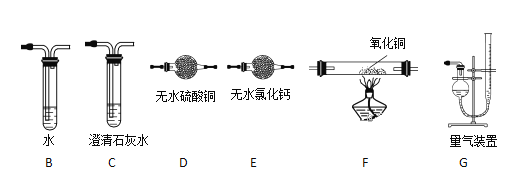
依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_________。有H2的实验现象是_________________________。
(3)已知HCHO![]() HCOOH
HCOOH![]() H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O。 假设二:只有Cu。
假设三:Cu2O和CuO 假设四:________________________ ;
假设_______明显不成立,理由是___________________________ 。
进行如下实验(以下每步均充分反应):

已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O ![]() H++OH-;ΔH > 0,下列叙述正确的是( )
H++OH-;ΔH > 0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中通入HCI气体,pH值减小,KW不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)增大
D. 将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.0g碳酸钙放入一定量稀盐酸中恰好完全反应,试计算:
(1)生成标准状况下的二氧化碳气体多少升?(不考虑CO2在水中的溶解)
(2)所得溶液中氯化钙的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、环境保护、资源利用、能源开发等密切相关。下列说法错误的是
A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
D.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42— + 16H+
下列说法不正确的是
A. “还原”后可以用KSCN检验Fe3+是否反应完全
B. “还原”时反应Ⅱ的离子方程式为2Fe3+ + FeS2 = 2S↓+ 3Fe2+
C. “沉淀”时,可以先将溶液调节成强碱性,再加入(NH4)2CO3
D. 所得FeCO3需充分洗涤,可以用稀盐酸和BaCl2溶液检验FeCO3是否已洗涤干净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25gmL﹣1、质量分数为36.5%的浓盐酸配制240mL 0.1molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为
(2)配制 240mL 0.1molL﹣1 的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次 ) .
A.用30mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤, .
②容量瓶中原有少量蒸馏水, .
③定容时观察液面俯视, .
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度 .
②向容量瓶中转移溶液时有滚液不慎有溶液溅出 .
③定容摇勻后发现液面下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com