
| A. | 原子序数B>A>C | B. | 原子最外层电子数C>A>B | ||
| C. | 原子半径A>C>B | D. | 离子半径A+>B2->C3+ |
分析 阴离子原子序数=核外电子数-电荷数,阳离子原子序数=核外电子数+电荷数,A、B、C是短周期三种元素,它们的离子A+、B2-、C3+具有相同的核外电子层结构,则原子序数C>A>B,A在B、C的上一周期,原子的电子层数越多其原子半径越大,电子层结构相同的离子,其离子半径随着原子序数增大而减小,以此解答该题.
解答 解:A.由以上分析可知原子序数C>A>B,故A错误;
B.由离子所带电荷可知A、B、C核外最外层电子数分别为1、6、3,故B错误;
C.B在C的上一周期,则C的原子半径比B大,A、C在同一周期,C的原子半径较小,则原子半径大小顺序为A>C>B,故C正确;
D.原子序数C>A>B,A+、B2-、C3+具有相同的核外电子层结构,核电荷数越大,离子半径越小,应为B2->A+>C3+,故D错误.
故选C.
点评 本题考查了原子结构和元素周期律的关系,根据原子序数、核外电子数、电荷数的关系确定元素,再结合离子半径、原子半径、原子结构等知识点分析解答,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:解答题
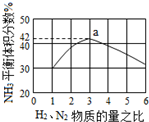 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~60 s,以X的浓度变化表示的反应速率为0.001 mol•L-1•s-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ”表示中子.
”表示中子.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
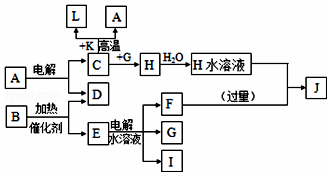 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图: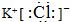
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4LCO2所含的原子数为3NA | |
| B. | 1molCl2与足量的Fe完全反应,转移的电子数为2NA | |
| C. | 0.5molC2H2和C6H6的气态混合物中所含原子总数为2NA | |
| D. | 2L1mol/L的盐酸中所含HCl分子数约为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com