
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
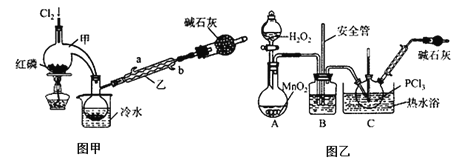
【实验Ⅰ】图甲制备PCl3
(1)实验室制备Cl2的反应方程式是_______________;
(2)碱石灰的作用除了处理尾气外还有_______________。
【实验Ⅱ】图乙制备POCl3
(3)装置B的作用除了干燥O2外,还有________________________;
(4)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+为指示剂,用0.2000mol/LKSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。 已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN)。
(5)POC13水解的化学反应方程式为________________________。
(6)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(7)反应中POC13的百分含量为________________。
【答案】 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 防止空气中的水蒸气进入烧瓶,影响产品纯度 平衡压强、观察氧气的流速 温度过高,PCl3会大量挥发,导致产量降低;温度过低,反应速率会变慢 POCl3+3H2O=H3PO4+3HCl 当滴入最后一滴标准KSCN溶液时,溶液变为血红色,且半分钟不褪去 使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应 50%
MnCl2+Cl2↑+2H2O 防止空气中的水蒸气进入烧瓶,影响产品纯度 平衡压强、观察氧气的流速 温度过高,PCl3会大量挥发,导致产量降低;温度过低,反应速率会变慢 POCl3+3H2O=H3PO4+3HCl 当滴入最后一滴标准KSCN溶液时,溶液变为血红色,且半分钟不褪去 使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应 50%
【解析】考查实验方案设计与评价,(1)实验室制备氯气,常用MnO2和浓盐酸共热产生,因此化学反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)根据信息(1),PCl3遇水生成H3PO2和HCl,因此碱石灰的目的不仅是尾气处理,还是防止空气中的水蒸气进入烧瓶中,造成PCl3水解;(3)装置B的作用干燥O2和、平衡压强、观察氧气的流速;(4)PCl3沸点为75.5℃,温度超过超过沸点,造成PCl3大量挥发,导致产量降低,如果温度过低,反应速率变慢;(5)按照水解定义,POCl3中P显+5价,POCl3水解的反应方程式为POCl3+3H2O=H3PO4+3HCl;(6)根据操作,用Fe3+作指示剂,滴定终点:当滴入最后一滴标准KSCN溶液时,溶液变为血红色,且半分钟不褪去;根据溶度积大小,AgSCN的溶度积小于氯化银,滴加KSCN溶液时,AgCl沉淀容易转化成AgSCN沉淀,影响实验结果,因此加入少量硝基苯的目的是使生成的沉淀与溶液隔离,避免滴定过程中AgCl与SCN-反应;(7)根据反应方程式,建立的关系式为POCl3~3HCl~3AgCl~3Ag+,参与生成AgCl的Ag+物质的量为:(10×10-3×3.2-10×10-3×0.2)mol=0.03mol,即POCl3的物质的量为0.03/3mol=0.01mol,样品中POCl3的质量为0.01×100×153.5/10g=15.35g,则纯度为15.35/30.70×100%=50%。
MnCl2+Cl2↑+2H2O;(2)根据信息(1),PCl3遇水生成H3PO2和HCl,因此碱石灰的目的不仅是尾气处理,还是防止空气中的水蒸气进入烧瓶中,造成PCl3水解;(3)装置B的作用干燥O2和、平衡压强、观察氧气的流速;(4)PCl3沸点为75.5℃,温度超过超过沸点,造成PCl3大量挥发,导致产量降低,如果温度过低,反应速率变慢;(5)按照水解定义,POCl3中P显+5价,POCl3水解的反应方程式为POCl3+3H2O=H3PO4+3HCl;(6)根据操作,用Fe3+作指示剂,滴定终点:当滴入最后一滴标准KSCN溶液时,溶液变为血红色,且半分钟不褪去;根据溶度积大小,AgSCN的溶度积小于氯化银,滴加KSCN溶液时,AgCl沉淀容易转化成AgSCN沉淀,影响实验结果,因此加入少量硝基苯的目的是使生成的沉淀与溶液隔离,避免滴定过程中AgCl与SCN-反应;(7)根据反应方程式,建立的关系式为POCl3~3HCl~3AgCl~3Ag+,参与生成AgCl的Ag+物质的量为:(10×10-3×3.2-10×10-3×0.2)mol=0.03mol,即POCl3的物质的量为0.03/3mol=0.01mol,样品中POCl3的质量为0.01×100×153.5/10g=15.35g,则纯度为15.35/30.70×100%=50%。


科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁。某化学兴趣小组对绿矾的某一性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,再向试管中通入氯气,溶液逐渐变红。由此可知硫酸亚铁的一些性质为:_________;此过程中涉及的反应离子方程式为_______________。
(2)为探究硫酸亚铁的分解产物,无水硫酸亚铁固体置于装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管A中残留固体为红色粉末。
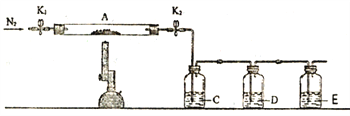
①C、D、E中的溶液依次为_______(填标号)。C、D中有气泡冒出,C、D中还可观察到的现象分别为________、________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出装置A中反应的化学方程式_____________。
③装置E的作用_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“文化自信”是我党提出的四大自信之一。古诗词热,仿佛一股清泉,浸润我们共同的文化基因,下列诗句不涉及化学反应的是( )
A.野火烧不尽,春风吹又生B.南朝四百八十寺,多少楼台烟雨中
C.春蚕到死丝方尽,蜡炬成灰泪始干D.爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B. 图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下。下列说法正确的是

A. 对苯二酚在空气中能稳定存在
B. 1mol该中间体最多可与12mol H2 反应
C. 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应
D. 该中间体1mol 与足量NaOH溶液反应可消耗7molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物的说法不正确的是
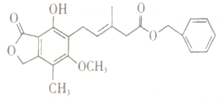
A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
C. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
D. 该化合物与足量NaOH反应可生成化学式为C16H17O7Na3的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
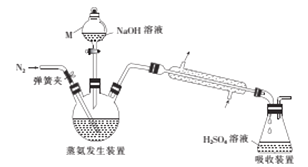
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com