
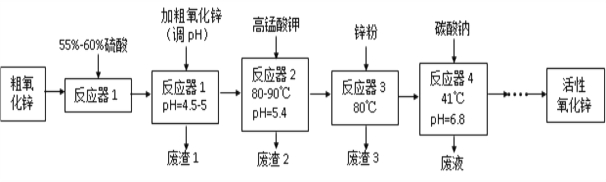
”¾ĢāÄæ”æ»īŠŌŃõ»ÆŠæ(ZnO)Į£¾¶½éÓŚ1-100 nmÖ®¼ä£¬ŹĒŅ»ÖÖĆęĻņ21ŹĄ¼ĶµÄŠĀŠĶøß¹¦Äܾ«ĻøĪŽ»ś²śĘ·£¬±ķĻÖ³öŠķ¶ąĢŲŹāµÄŠŌÖŹ”£Ä³ŃŠ¾æĖłŅŌ“ÖŃõ»ÆŠæ£Øŗ¬ÉŁĮæCuO”¢FeO”¢MnO”¢Fe2O3µČ£©ĪŖŌĮĻ£¬²ÉÓĆŹŖ»Æѧ·Ø(NPP-·Ø)ÖʱøÄÉĆ×¼¶»īŠŌŃõ»ÆŠæ£¬Éś²ś¹¤ŅÕĮ÷³ĢČēĶ¼£ŗ
ŅŃÖŖ£ŗ
¢ŁpH=5.4Ź±£¬KMnO4µÄ»¹Ō²śĪļĪŖMnO2”£
¢ŚŅŌÉĻŹµŃéĢõ¼žĻĀø÷ÖÖĒāŃõ»ÆĪļ³ĮµķµÄpHĒéæöČēĻĀ±ķĖłŹ¾”£
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
æŖŹ¼³ĮµķµÄpH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
³ĮµķĶźČ«µÄpH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
øł¾ŻŅŌÉĻŠÅĻ¢£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©¹¤ŅÕ¹ż³ĢÖŠø÷²½Öč¾łÓƵ½µÄ·ÖĄė·½·ØŹĒ_______________________________”£
£Ø2£©”°·ĻŌü1”±µÄÖ÷ŅŖ³É·ÖŹĒ______________________________________________”£
£Ø3£©”°·“Ó¦Ę÷2”±ÖŠĮ½øöŃõ»Æ»¹Ō·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_______________________________________________________________
£Ø4£© ”°·“Ó¦Ę÷3”±ÖŠ¼ÓČėŠæ·ŪµÄ×÷ÓĆŹĒ________________________________”£
£Ø5£©”°·“Ó¦Ę÷4”±µĆµ½µÄ·ĻŅŗÖŠ£¬ŗ¬ÓŠµÄÖ÷ŅŖĄė×Ó³żĮĖNa+Ķā£¬»¹ÓŠ______________”£
”¾“š°ø”æ ¹żĀĖ Fe(OH)3 MnO4£ + 3Fe2+ + 4H+ = 3Fe3+ + MnO2”ż+ 2H2O£¬2MnO4£ +3Mn2++2H2O = 5MnO2”ż+ 4H+ ³żČ„ČÜŅŗÖŠCu2+ K+”¢SO42©
”¾½āĪö”æ£Ø1£©±¾Ģāæ¼²éĪļÖŹµÄ³żŌÓŗĶ·ÖĄė£¬øł¾ŻĮ÷³Ģ£¬ø÷²½ÖčµĆµ½µÄŹĒĀĖŅŗŗĶĀĖŌü£¬Ņņ“Ė·ÖĄė·½·ØŹĒ¹żĀĖ£»£Ø2£©±¾Ģāæ¼²éÄŃČܵē½āÖŹČܽāĘ½ŗāµÄÓ¦ÓĆ£¬·“Ó¦Ę÷1£¬¼Ó“ÖŃõ»ÆŠæµÄÄæµÄŹĒµ÷½ŚpH£¬µ÷ÖĮ4.5£5£¬øł¾Ż±ķøńŹż¾Ż£¬Fe3£«ŅŌĒāŃõ»ÆĢśµÄŠĪŹ½³Įµķ³öĄ“£¬¼“ĀĖŌü1ĪŖFe(OH)3£»£Ø3£©±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦·½³ĢŹ½µÄŹéŠ“£¬øł¾Ż“ÖŃõ»ÆŠæµÄ³É·Ö£¬·“Ó¦Ę÷1ÖŠŗ¬ÓŠFe2£«£¬Ņņ“Ė¼ÓČėøßĆĢĖį¼ŲČÜŅŗµÄÄæµÄÖ®Ņ»ŹĒ°ŃFe2£«Ńõ»Æ³ÉFe3£«£¬Č»ŗóµ÷½ŚpH£¬³żČ„£¬Ņņ“ĖĄė×Ó·“Ó¦·½³ĢŹ½ĪŖMnO4£ + 3Fe2£« + 4H£« = 3Fe3£« + MnO2”ż+ 2H2O£¬øł¾Ż“ÖŃõ»ÆŠæµÄ³É·Ö£¬·“Ó¦Ę÷1ÖŠµĆµ½µÄĄė×Ó»¹ŗ¬ÓŠMn2£«£¬øł¾ŻĮ÷³ĢĶ¼£¬¼ÓČėĖįŠŌøßĆĢĖį¼ŲČÜŅŗµÄÄæµÄÖ®¶žŹĒ³żČ„Mn2£«£¬Ąė×Ó·“Ó¦·½³ĢŹ½ĪŖ2MnO4£ +3Mn2£«+2H2O = 5MnO2”ż+ 4H£« £»£Ø4£©±¾ĢāĪļÖŹµÄ³żŌÓ£¬±¾Į÷³ĢµÄÄæµÄŹĒµĆµ½»īŠŌŃõ»ÆŠæ£¬øł¾Ż·“Ó¦Ę÷1ŗĶ2£¬·“Ó¦Ę÷3µÄÄæµÄŹĒ³żČ„Cu2£«£¬Ņņ“ĖĄūÓĆ½šŹō»ī¶ÆŠŌ£¬·¢ÉśZn£«Cu2£«=Zn2£«Cu£¬¼ÓČėŠæµÄÄæµÄŹĒ³żČ„ČÜŅŗÖŠCu2£«£»£Ø5£©æ¼²éĄė×ӵēęŌŚ£¬øł¾ŻĮ÷³ĢĶ¼£¬·“Ó¦Ę÷4ÖŠµÄ·ĻŅŗÖŠŗ¬ÓŠNa£«”¢K£«”¢SO42£µČ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌĻĀĮŠÓŠ»ś»ÆѧµÄČĻŹ¶ÖŠ£¬“ķĪóµÄŹĒ
A. ·“Ó¦ ![]() ŹōÓŚČ”“ś·“Ó¦
ŹōÓŚČ”“ś·“Ó¦
B. µķ·ŪŗĶĻĖĪ¬ĖŲŹōÓŚ¶ąĢĒ£¬ŌŚČĖĢåÄŚĖ®½ā×Ŗ»ÆĪŖĘĻĢŃĢĒ£¬ĪŖČĖĄąĢį¹©ÄÜĮæ
C. ·ÖÖ¦Ėį½į¹¹¼ņŹ½ČēĶ¼ £¬æÉÓėŅŅ“¼”¢ŅŅĖį·“Ó¦£¬Ņ²æÉŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ”¢ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«
£¬æÉÓėŅŅ“¼”¢ŅŅĖį·“Ó¦£¬Ņ²æÉŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ”¢ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«
D. Č”ÕįĢĒĖ®½āŅŗÉŁŠķ£¬ĻȵĪ¼Ó¹żĮæµÄNaOHČÜŅŗ£¬ŌŁµĪČėŠĀÖʵÄĒāŃõ»ÆĶŠü×ĒŅŗ£¬¼ÓČČ£¬ÓŠŗģÉ«³ĮµķÉś³É£¬Ö¤Ć÷ĘäĖ®½ā²śĪļ¾ßÓŠ»¹ŌŠŌ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĢõ¼žĻĀ£¬½«3 mol AŗĶ1 mol BĮ½ÖÖĘųĢå»ģŗĻÓŚ¹Ģ¶ØČŻ»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗ3A£Øg£©£«B£Øg£©![]() xC£Øg£©£«2D£Øg£©”£2 minÄ©øĆ·“Ó¦“ļµ½Ę½ŗā£¬²āµĆÉś³É0.8 mol D£¬ 0.4 mol C”£ĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ
xC£Øg£©£«2D£Øg£©”£2 minÄ©øĆ·“Ó¦“ļµ½Ę½ŗā£¬²āµĆÉś³É0.8 mol D£¬ 0.4 mol C”£ĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ
A. x £½1
B. 2 minŹ±£¬AµÄÅضČĪŖ0.9mol”¤L-1
C. 2 minÄŚAµÄ·“Ó¦ĖŁĀŹĪŖ0.3 mol”¤L-1”¤min-1
D. BµÄ×Ŗ»ÆĀŹĪŖ60%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀĻĀ£¬ÓĆ0.100 mol”¤L£1 NaOHČÜŅŗ·Ö±šµĪ¶Ø20.00 mL 0.100 mol”¤L£1µÄŃĪĖįŗĶ“×Ėį£¬µĪ¶ØĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)

A. ¢ņ±ķŹ¾µÄŹĒµĪ¶Ø“×ĖįµÄĒśĻß
B. pH£½7Ź±£¬µĪ¶Ø“×ĖįĻūŗĵÄV(NaOH)Š”ÓŚ20 mL
C. V(NaOH)£½20.00 mLŹ±£¬Į½·ŻČÜŅŗÖŠc(Cl£)£½c(CH3COO£)
D. V(NaOH)£½10.00 mLŹ±£¬“×ĖįČÜŅŗÖŠc(Na£«)>c(CH3COO£)>c(H£«)>c(OH£)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ2016Äź9ŌĀĪŅ¹ś³É¹¦ĄūÓĆ“ó¹¦ĀŹŌĖŌŲ»š¼ż·¢Éä”°Ģģ¹¬¶žŗÅ”±æÕ¼äŹµŃéŹŅ”£»š¼żĶĘ½ųĘ÷֊װӊ»¹Ō¼ĮėĀ£ØN2H4£©£ØŅŗĢ¬£©ŗĶĒæŃõ»Æ¼Į¹żŃõ»ÆĒā£ØH2O2£©£¬ČēĶ¼ŹĒŅ»¶ØĮæėĀĶźČ«·“Ӧɜ³ÉµŖĘųŗĶĖ®¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆĶ¼”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
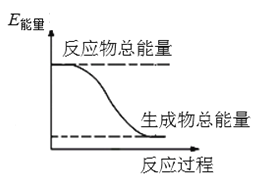
£Ø1£©ėĀÓÖĆūĮŖ°±£¬ĒėĶĘ²āĖüµÄ½į¹¹Ź½£ŗ__________________________”£
£Ø2£©ŅŗĢ¬ėĀÓė¹żŃõ»ÆĒāµÄ·“Ó¦ŹōÓŚ________£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£
£Ø3£©Š“³öøĆ»š¼żĶĘ½ųĘ÷ÖŠĻą¹Ų·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_____________________”£
£Ø4£©ŅŃÖŖėĀŗĶŃõĘųæÉ·¢ÉśČēĻĀ·“Ó¦£ŗN2H4£Øg£©+O2£Øg£©N2£Øg£©+2H2O£Øg£©
¢ŁÄ³ĪĀ¶ČĻĀ£¬ČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ£¬ĻĀĮŠĆčŹöæÉĖµĆ÷ÉĻŹö·“Ó¦“ļµ½Ę½ŗāµÄŹĒ______”£
A. ¦Ō£ØN2£© = ¦Ō£ØN2H4£©
B. c£ØN2H4£© : c£ØO2£© : c£ØN2£© = 1:1:1
C. »ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ·¢Éś±ä»Æ
D. ĢåĻµµÄŃ¹Ēæ²»ŌŁ·¢Éś±ä»Æ
E. »ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ·¢Éś±ä»Æ
F. Ćæ¶ĻæŖ1 mol O=O¼ü£¬Ķ¬Ź±¶ĻæŖ4 mol H-O¼ü
¢ŚČōĻėŅŖŌö¼ÓøĆ·“Ó¦µÄÕż·“Ó¦ĖŁĀŹ£¬ÄćČĻĪŖŅ»¶ØæÉŠŠµÄ·½·ØÓŠ£ŗ____________”£
A. Éżøß·“Ó¦ĪĀ¶Č B. ¼ÓČėŹŹµ±µÄ“߻ƼĮ
C. ĻņČŻĘ÷ÖŠ¼ÓČėŃõĘų D. ĻņČŻĘ÷ÖŠ¼ÓČėÄŹĘų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃéĻÖĻóŌ¤²āÕżČ·µÄŹĒ( )
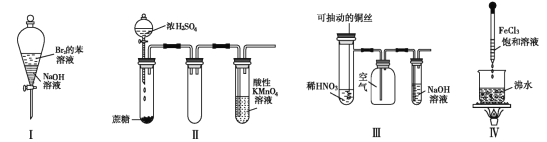
A. ŹµŃé¢ń£ŗÕńµ“ŗó¾²ÖĆ£¬ÉĻ²ćČÜŅŗŃÕÉ«±£³Ö²»±ä
B. ŹµŃé¢ņ £ŗĖįŠŌ KMnO4 ČÜŅŗÖŠ³öĻÖĘųÅŻ£¬ĒŅŃÕÉ«Öš½„ĶŹČ„
C. ŹµŃé¢ó£ŗĪ¢ČČĻ” HNO3 ʬæĢ£¬ČÜŅŗÖŠÓŠĘųÅŻ²śÉś£¬¹ćæŚĘæÄŚŹ¼ÖÕ±£³ÖĪŽÉ«
D. ŹµŃé¢ō£ŗµĪČė FeCl3 ŗó£¬æÉŠĪ³É“ųµēµÄ½ŗĢ壬øĆ·ÖÉ¢Ļµµ¼µēÄÜĮ¦ŌöĒæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”擼Ąą»ÆŗĻĪļŌŚĻćĮĻÖŠÕ¼ÓŠÖŲŅŖµÄµŲĪ»£¬ĻĀĆęĖłĮŠµÄŹĒŅ»Š©ĢģČ»µÄ»ņŗĻ³ÉµÄ“¼ĄąĻćĮĻ£ŗ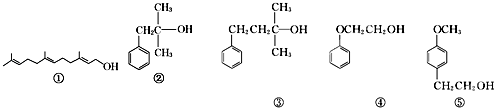
ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£©
A.æÉÓĆĖįŠŌKMnO4ČÜŅŗ¼ģŃé¢ŁÖŠŹĒ·ńŗ¬ÓŠĢ¼Ģ¼Ė«¼ü
B.¢ŚŗĶ¢Ū»„ĪŖĶ¬ĻµĪļ£¬¾łÄÜ“ß»ÆŃõ»ÆÉś³ÉČ©
C.¢ÜŗĶ¢Ż»„ĪŖĶ¬ĻµĪļ£¬æÉÓĆŗĖ“Ź²ÕńĒāĘ×¼ģŃé
D.µČĪļÖŹµÄĮæµÄÉĻŹö5ÖÖÓŠ»śĪļÓė×ćĮæµÄ½šŹōÄĘ·“Ó¦£¬ĻūŗÄÄʵÄĮæĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢśæóŹÆŹĒ¹¤ŅµĮ¶ĢśµÄÖ÷ŅŖŌĮĻÖ®Ņ»£¬ĘäÖ÷ŅŖ³É·ÖĪŖĢśµÄŃõ»ÆĪļ(ÉčŌÓÖŹÖŠ²»ŗ¬ĢśŌŖĖŲŗĶŃõŌŖĖŲ£¬ĒŅŌÓÖŹ²»ÓėH2SO4·“Ó¦)”£Ä³ŃŠ¾æŠŌѧĻ°Š”×é¶ŌijĢśæóŹÆÖŠĢśµÄŃõ»ÆĪļµÄ»ÆѧŹ½½ųŠŠĢ½¾æ”£
I”¢ĢśæóŹÆÖŠŗ¬ŃõĮæµÄ²ā¶Ø
¢Ł°“ĻĀĶ¼×é×°ŅĒĘ÷£¬¼ģ²é×°ÖƵÄĘųĆÜŠŌ£»
¢Ś½« 10.0g ĢśæóŹÆ·ÅČėÓ²ÖŹ²£Į§¹ÜÖŠ£¬×°ÖĆB”¢CÖŠµÄŅ©Ę·ČēĶ¼ĖłŹ¾£Ø¼Š³ÖŅĒĘ÷¾łŹ”ĀŌ£©£»
¢Ū“Ó×ó¶Ėµ¼Ęų¹ÜæŚ“¦²»¶ĻµŲĶØČė H2£¬______£¬µćČ¼ A “¦¾Ę¾«µĘ£»
¢Ü””
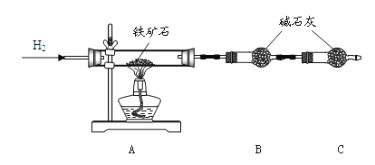
(1)×°ÖĆ C µÄ×÷ÓĆĪŖ_______________________________________ ”£
(2)½«²½Öč¢ŪµÄ²Ł×÷²¹³äĶźÕū£ŗ_________”£
(3)ŹµŃé½įŹųŗóµÄ²Ł×÷°üĄØ£ŗ a.ĄäČ“ÖĮŹŅĪĀ b.ĻØĆš A “¦µÄ¾Ę¾«µĘ c.Ķ£Ö¹ĶØ H2”£ÕżČ·µÄĖ³ŠņĪŖ£ŗ_________£ØĢīŠņŗÅ£©”£
(4)ŹµŃé²āµĆ·“Ó¦ŗó×°ÖĆ BŌöÖŲ 2.7g£¬¾Ż“ĖæÉŅŌ²ā³öĢśæóŹÆÖŠŃõµÄŗ¬Į攣ӊĶ¬Ń§ČĻĪŖ£¬²»²ā¶Ø B ×°ÖĆµÄ¾»ŌöÖŹĮ棬Ķعż²ā¶Ø_________£¬Ņ²ÄÜ“ļµ½ŹµŃéÄæµÄ”£
II”¢ĢśæóŹÆÖŠŗ¬ĢśĮæµÄ²ā¶Ø
½«ÉĻŹöŹµŃé½įŹųŗóÓ²ÖŹ²£Į§¹ÜÖŠµÄ¹ĢĢåČ«²æČ”³ö£¬ÓĆ×ćĮæĻ”ĮņĖį½žČ”ŗó¹żĀĖ”£ĻņĀĖŅŗÖŠĶØČė×ćĮæCl2 ²¢¼ÓČČÖ󷊵ĆČÜŅŗ M£¬ĄäČ“ŗó½«ČÜŅŗ M Ļ”ŹĶÖĮ 250mL”£Č” 20.00mL M µÄĻ”ČÜŅŗ£¬ÓĆ 0.5000mol”¤L-1µÄ±ź×¼ KI ČÜŅŗÓėĘä·“Ó¦£¬ĻūŗÄ KI ČÜŅŗ 20.00 mL”£
(5)ĻņĀĖŅŗÖŠĶØČė×ćĮæ Cl2 µÄÄæµÄŹĒ½«ĘäÖŠµÄ Fe2+Ńõ»Æ³É Fe3+”£½«ĶØČė Cl2 ŗóµÄČÜŅŗ¼ÓČČÖ󷊵ÄÄæµÄŌņŹĒ_________”£ ČōŹ”Č„øĆ²Ł×÷£¬ŌņĖł²āĢśµÄ°Ł·Öŗ¬Į潫_________”££ØĢī”°Ę«“ó”±£¬ ”°Ę«Š””±»ņ”°ĪŽÓ°Ļģ”±£©”£
(6)±ź×¼ KI ČÜŅŗÓė M Ļ”ČÜŅŗ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ_________”£
III”¢»ÆѧŹ½µÄČ·¶Ø
(7)½įŗĻ I”¢ II µÄŹµŃ鏿¾Ż¼ĘĖćøĆĢśæóŹÆÖŠĢśµÄŃõ»ÆĪļµÄ»ÆѧŹ½ĪŖ_________”£ (Ēė»Æ³É×ī¼ņµ„µÄÕūŹż±Č)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĘųĢ¬ĢžAµÄĆܶȏĒĻąĶ¬×“æöĻĀĒāĘųĆܶȵÄ14±¶£¬ÓŠ»śĪļA~EÄÜ·¢ÉśĻĀĶ¼ĖłŹ¾Ņ»ĻµĮŠ±ä»Æ£¬ŌņĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
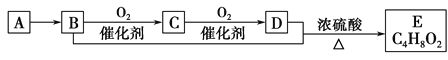
A. A·Ö×ÓÖŠĖłÓŠŌ×Ó¾łŌŚĶ¬Ņ»Ę½ĆęÄŚ
B. C4H8O2ŗ¬õ„»łµÄĶ¬·ÖŅģ¹¹ĢåÓŠ4ÖÖ
C. CµÄĖ®ČÜŅŗÓÖ³Ęø£¶ūĀķĮÖ£¬¾ßӊɱ¾ś”¢·ĄøÆŠŌÄÜ
D. µČĪļÖŹµÄĮæµÄB”¢DÓė×ćĮæÄĘ·“Ӧɜ³ÉĘųĢåµÄĮæĻąµČ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com