
| V |
| Vm |
| n |
| V |
| m |
| M |
| 11.2L |
| 22.4L/mol |
| 1mol |
| 0.5L |
| 16g |
| 64g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、该硫酸的物质的量浓度为9.2mol/L |
| B、1molZn与足量的该硫酸反应产生2g氢气 |
| C、配制200ml4.6mol/L的稀硫酸需取该硫酸50mL |
| D、该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:4 | B、1:3 |
| C、2:3 | D、5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校化学研究性学习小组以铜为电极电解饱和食盐水,探究过程如下:
某校化学研究性学习小组以铜为电极电解饱和食盐水,探究过程如下:| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸 | 砖红色沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸 | 砖红色沉淀转变为紫红色不溶物,溶液呈蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色 | 氯化亚铜 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、杂质一定不含KNO3 |
| B、杂质一定含有Ba(NO3)2可能还含有KNO3 |
| C、杂质一定不含Na2SO4 |
| D、杂质一定含KNO3可能还含有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
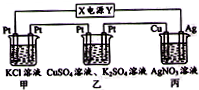
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL.
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com