
【化学-选修3:物质结构与性质】
A、B、C、D、E五种元素的原子序数依次增大。A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍;D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态D原子核外电子的排布式为___________________。
(2)B、C、D三种元素的电负性由大到小的顺序是_______________________(填元素符号)。
(3)E(NH3)2+ 4离子的颜色是___________;含有化学键类型是_________________;离子中N原子杂化轨道类型是_________________。
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为_________;在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质。该化学反应方程式为___________________________。

(5)若甲的密度为ρ g/cm3,NA表示阿伏加德罗常数,则甲晶胞的边长可表示为_________cm。
科目:高中化学 来源:2017届内蒙古高三上9月月考化学卷(解析版) 题型:选择题
O2F2可以发生反应:H2S+4O2F2 = SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:选择题
下列有关硫元素及其化合物的说法或描述正确的是
A.硫黄矿制备硫酸经历两步:S SO3
SO3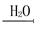 H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为
2CaCO3+2SO2+O2===2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
短周期元素A、B、C的原子序数之和为37,A、B在同一周期,A+、C-具有相同的核外电子层结构。下列推测不正确的是( )
A. 同周期元素中C的氢化物稳定性最强
B. 同周期元素中A的金属性最强
C. 原子半径:A>B,离子半径:A+>C-
D. A、B、C的简单离子中,会破坏水的电离平衡的是C
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使红色石蕊试纸变蓝色的溶液中: K+、CO32- 、NO3- 、AlO2-
B.滴人酚酞溶液显红色的溶液中: K+、Na+、Cu2+、SO42-
C.由水电离产生的(H+) = 10-13mol/L的溶液中:Na+、Cl-、NO3-、CH3COO-
D.pH = l 的溶液中: Na+、Fe2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列对如图两烧杯溶液分析一定正确的是
A.甲、乙两烧杯中水电离出的H+浓度:甲<乙
B.分别稀释相同倍数,溶液pH变化:甲=乙
C.相同条件下,AgCl(s)在甲中溶解度大于在乙中
D.向甲烧杯加入NaOH使溶液中性后一定存在:c(Na+)= c(CH3COO-)+ c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:实验题
ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。


图1 图2
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。
已知Ⅰ.NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;
Ⅱ.NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④ ;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③原ClO2溶液的浓度为 g·L-1(用含字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述不正确的是( )
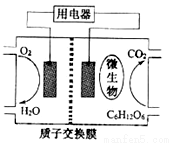
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C.放电过程中,质子(H+)从负极区向正极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标
准状况下CO2气体22.4 L
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:填空题
某兴趣小组模拟企业对含铬废水(Cr2O72-和Cr3+)处理流程如下。

已知:2CrO42-+2H+=Cr2O72-+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应: 。
(2)操作Ⅰ得到的残渣的化学式为 。
(3)操作Ⅲ调节pH时最适合作为调节剂的是
A.4mol·L-1盐酸 B.6mol·L-1硫酸
C.石灰乳 D.碳酸钠
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr3+,再用amol·L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
①滴定时采用右图所示的侧边自动定零位滴定管,具有的优点 。

②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为 mg·L-1(用含a、b的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com