
���� ��1��pH=-lgc��H+�������㣻
��2��������������ʣ�������ȫ���룻
��3����ѧʽ���Ƶ����ʵ��ܶȻ�����ԽС��������Խ���ܣ����ݳ�����ת���ĽǶȷ�����
��4��pH=13��Ba��OH��2��Һ�������Ӷ�����ˮ���������ˮ���������c��H+��������Һ��ˮ�����c��OH-����
��5������������ʵ���Ũ��Ϊ��C��HCl��������������ֱ�Ϊ1L��9L���ֱ���������������Ӻ������ӵ����ʵ��������߷�������кͣ�������ҺpH=11��֪��ʣ�࣬���ʣ������������ӵ����ʵ��������ݣ�Kw=c��H+����c��OH -��������
��6����Ӧǰ�ͷ�Ӧ��Ԫ�غʹ�����Һ��������Ũ����ȣ����ݴ���Ϊ������ʡ�����Ϊǿ����ʷ�������п��������С��
��� �⣺��1������Ϊǿ�ᣬ0.1mol/L�����ᣬPH=-lgc��H+��=-lg0.1=1��
�ʴ�Ϊ��1����
��2�������£�ij������Һ��pH=1������PH=-lgc��H+����c��H+��=0.1mol/L������Ϊ������ʣ�����Һ�в��ֵ��룬��Ũ�ȴ���0.1mol/L��
�ʴ�Ϊ������
��3����AgCl������Һ�м�������ŨNaBr��Һ������AgBr������˵��AgBr��AgCl�����ܣ�˵��Ksp��AgCl����Ksp��AgBr����
�ʴ�Ϊ����
��4����pH=13��Ba��OH��2��Һ����������ˮ���������ˮ���������c��H+��������Һ��ˮ�����c��OH -������ˮ�����c��OH -��=c��H+��=10-13mol/L��
�ʴ�Ϊ��10-13 mol•L-1��
��5������������ʵ���Ũ��Ϊ��C��HCl��������������ֱ�Ϊ1L��9L����n��OH -��=0.1mol/L��1L=0.1mol��n��H+��=C��HCl����9L����Ӧ��ʣ�����������ӵ����ʵ���Ϊ��0.1mol-c��HCl����9L���л��������ҺpH=11����֪��Ϻ�c��H+��=10-11 mol•L-1�����Ϻ�c��OH -��=$\frac{{K}_{w}}{C��{H}^{+}��}$=10-3 mol•L-1��
����$\frac{0.1mol/L-C��HCl����9L}{10L}$=10-3 mol•L-1����ã�c��HCl��=10-2mol•L-1��pH=-lg[H+]������pH=2��
�ʴ�Ϊ��2
��6������ʹ����pH�仯������2��4��������������Ũ����С���������д��ڵ���ƽ�⣬�����Ӻ�п��Ӧʱ�ٽ�������룬���䷴Ӧ�������ӣ����Դ����DZ߷�Ӧ�ߵ���H+������Ӧ����Һ��pH��ȣ���������Ũ����ȣ����Է�Ӧ�����д������ĵ�Zn�࣬��������п������m1��m2��
�ʴ�Ϊ������
���� ���⿼������Һ���������ҺpH�ļ��㡢������ʵĵ���ƽ���֪ʶ����Ŀ�Ѷ��еȣ�ע��������Һ���������ҺpH�ļ��㷽������ȷ�����������Һ�в��ֵ�����ص㣮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 molKClO3 | B�� | 22.4LHCl���� | C�� | 2 molNaCl | D�� | 1 mol AlCl3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ��ɫ | C�� | ԭ���� | D�� | �ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
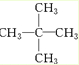 ������Ϊ2��2-�������飨�����飩��
������Ϊ2��2-�������飨�����飩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2S+SO2�T3S��+2H2O | |
| B�� | AlCl3+3NaAlO2+6H2O�T4Al��OH��3��+3NaCl | |
| C�� | 2NaBr+Cl2�T2NaCl+Br2 | |
| D�� | 2FeCl3+H2S�T2FeCl2+2HCl+S�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com