
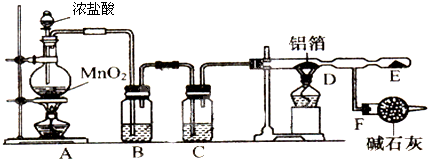
分析 (1)根据浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水书写;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢和水蒸气,然后根据除杂要求分析;
(3)根据氯气中含有氯化氢和水蒸气,进入D管氯化氢和铝能反应生成氢气,氢气和氯气混合会发生爆炸,据此判断;
(4)根据氯气的性质和碱石灰的成分判断.
解答 解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢,氯化氢极易溶于水,氯气难溶于饱和食盐水,所以选饱和食盐水除去氯化氢;因题中要求制取纯净的无水AlCl3,所以要除去氯气中混有的水蒸气,且不引进新的杂质、氯气也和该物质不反应,所以选浓硫酸;
故答案为:饱和食盐水;浓硫酸;
(3)因浓盐酸具有挥发性,反应生成物中有水,在加热条件下变成水蒸汽,所以混合气体中的成分是氯化氢、水蒸气、氯气;氯化氢和铝能反应生成氢气,氢气和氯气混合会发生爆炸.
故答案为:未经除去的氯化氢和水蒸气随氯气进入D中和铝能反应生成氢气,氢气和氯气混合会发生爆炸;
(4)氯气有毒,污染环境,所以不能排空;碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应达到,所以可用碱石灰处理尾气;空气中有水蒸气,碱石灰还能吸收水蒸气,所以可作干燥剂.
故答案为:吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入D中.
点评 本题主要考查了物质的制备,除杂和提纯,注意利用题目信息分析问题,培养了学生解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
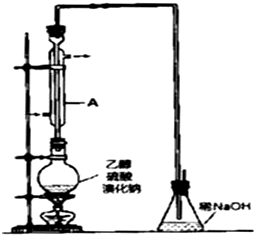 有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O.
有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | D | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的体积分数不再随时间变化时表示反应达平衡状态 | |
| B. | 35 oC时,达平衡时,X分解了 0.03 mol | |
| C. | 该反应在高温下可能自发 | |
| D. | 若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
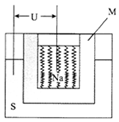 如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx.该电池正极的电极反应式为xS+2e-=Sx2-.
如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx.该电池正极的电极反应式为xS+2e-=Sx2-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com